时间:2020-07-08 01:44:11
1、填空题 请根据构造原理,写出下列元素基态原子的电子排布式:
(1)C ___________________。
(2)Ne__________________ 。
(3)S ___________________。
(4)32Ge________________ 。
参考答案:(1)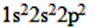
(2)
(3)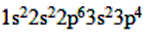
(4)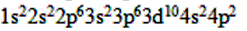
本题解析:
本题难度:一般
2、选择题 与氖的核外电子排布相同的阴离子及阳离子所构成的化合物可能是( )
A.溴化镁
B.氧化钠
C.氯化钾
D.硫化钠
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列电子层中,包含有f能级的是
[? ]
A.K电子层
B.L电子层
C.M电子层
D.N电子层
参考答案:D
本题解析:
本题难度:简单
4、选择题 基态原子电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A.+1
B.+2
C.+3
D.-1
参考答案:基态原子电子排布为1s22s22p63s23p1,价电子为3s23p1,说明最外层电子数为3,在反应中已失去,则化合价为+3,
故选C.
本题解析:
本题难度:简单
5、选择题 关于硫原子核外电子的叙述错误的是( )
A.排布在K、L、M三个电子层上
B.3p亚层上有2个空轨道
C.共有16种不同的运动状态
D.共有5种不同的能量
参考答案:B
本题解析:
本题难度:简单