时间:2020-07-08 01:43:43
1、选择题 决定1mol不同气体体积大小的主要因素有
①气体分子直径②气体分子数目③气体分子间距④气体分子质量
A.①②③
B.②③
C.③
D.③④
参考答案:C
本题解析:影响物质的体积的因素有三个,粒子数、粒子大小和粒子之间距离。1mol气体,分子数确定,影响因素只有分子之间的距离。
本题难度:一般
2、填空题 实验室配制480mL?0.1mol/L的氢氧化钠溶液,请回答下列问题:
(1)称量______g氢氧化钠固体时应放在______中进行:
(2)配制时应选用______容量瓶;
(3)在此配制过程中胶头滴管的作用是______;
(4)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”“偏低”或“无影响”):
A.加水定容时超过刻度线______;
B.没有将洗涤液转入容量瓶中______;
C.容量瓶内壁沾有水滴没有烘干就进行配制______;
D.定容时俯视______;
(5)与配制5%的氢氧化钠溶液相比:
①用到的相同仪器:______;
②用到的不同仪器:______.
参考答案:(1)因氢氧化钠易潮解,需放在玻璃器皿中称量,并在烧杯中溶解,故答案为:小烧杯(或表面皿);烧杯;
(2)因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,故答案为:500mL;
(3)因当液面距刻度线1-2cm时改用胶头滴管滴加水,故答案为:滴加水至凹液面最低点与刻度线相切;
(4)A.加水定容时超过刻度线,溶液的体积偏大,浓度偏小,故答案为:偏低;
B.没有将洗涤液转入容量瓶中,溶质的质量减少,浓度偏低,故答案为:偏低;
C.容量瓶内壁沾有水滴没有烘干就进行配制,无影响,浓度不变,故答案为:无影响;
D.定容时俯视,溶液的体积偏小,浓度偏大,故答案为:偏高;
(5)根据配制一定物质的量浓度溶液步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
配制5%的氢氧化钠溶液的步骤:计算、称量、量取、溶解,先计算出溶质质量为:90×10%=9克,水的质量为90-9=81克,用钥匙取药品,用天平称量药品(要用到药匙)放入烧杯内,用量筒量(要用到胶头滴管)取水倒入烧杯中,用玻璃棒搅拌.所以需要的仪器为:天平称量、药匙、量筒、胶头滴管、烧杯、玻璃棒,
①用到的相同仪器为托盘天平、药匙、烧杯、玻璃棒、胶头滴管,故答案为:托盘天平、药匙、烧杯、玻璃棒、胶头滴管;
②用到的不同仪器为量筒与500mL容量瓶,故答案为:量筒与500mL容量瓶.
本题解析:
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1 mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28 g混合气体中含有2NA个氢原子
C.1mol Na2O2固体中含有NA个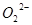
D.将含0.1 mol氯化铁的饱和溶液滴加到沸水中可制取0.1NA个 Fe(OH)3胶体微粒
参考答案:C
本题解析:考查阿伏加德罗常数的应用。1 mol硫酸钾中阴离子所带电荷数为2NA,选项A不正确;乙烯(C2H4)和环丙烷(C3H6)的最简式相同,都是CH2,所以28 g混合气体中含有4NA个氢原子,选项B不正确;氯化铁与水反应制取胶体的反应是可逆的,选项D不正确,答案选C。
本题难度:一般
4、填空题 实验室用98%、密度为1.84g/cm3的硫酸,配制浓度为0.46mol/L的稀硫酸溶液200mL.
(1)下面为实验过程中部分操作,正确的顺序为______
①用量筒量取浓硫酸;②洗涤烧杯和玻璃棒3次并将洗涤液转移到容量瓶内;③振荡摇匀;
④稀释浓硫酸;⑤用胶头滴管加水至刻度;⑥将稀释后的稀硫酸转入容量瓶
(2)回答下列问题
①稀释浓硫酸的操作:______;
②用量筒量取浓硫酸______mL;
③量取浓硫酸的体积时,如果仰视读数,则配制的稀硫酸的物质的量浓度偏______(高或低).
参考答案:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为①④⑥②⑤③.
故答案为:①④⑥②⑤③.
(2))①稀释浓硫酸的操作:将浓硫酸沿着烧杯壁慢慢注入水中,并不断搅拌.
故答案为:将浓硫酸沿着烧杯壁慢慢注入水中,并不断搅拌.
②98%、密度为1.84g/cm3的硫酸的物质的量浓度为1000×1.84×98%98=18.4mol/L,实验室200mL容量瓶不常见,选择250ml容量瓶.令需浓硫酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×18.4mol/L=250mL×0.46mol/L,解得:V=6.3ml.
故答案为:6.3.?
③量取浓硫酸的体积时,如果仰视读数,量取的浓硫酸的体积偏大,配制的稀硫酸的物质的量浓度偏高.
故答案为:高.
本题解析:
本题难度:一般
5、填空题 (1)已知KClO3+NH4NO2→KCl+NH4NO3指出以上反应中的氧化剂是______,被氧化的元素是______?(标出化合价).
(2)将190g?MgCl2溶于水配制成1L溶液.
①该溶液中MgCl2的物质的量浓度为______,溶液中Cl-的物质的量浓度为______.
②配制1mol?L-1的MgCl2溶液500mL,需该溶液的体积为______.
③向②中500mL溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol?L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为______,通入HCl气体的体积(标准状况下)为______.
参考答案:(1)因KClO3中的氯元素的化合价由+5价降低到-1价,所以KClO3是氧化剂,NH4NO2中亚硝酸根离子上的N由+3价升高到+5价,被氧化,故答案为:KClO3;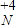
(2)①MgCl2的物质的量为n(MgCl2)190g95g/mol=2mol,则MgCl2物质的量浓度为C(MgCl2)2mol1L=2 mol/L,溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=4mol/L,故答案为:2mol/L;4mol/L;
②因溶液稀释前后溶质的物质的量不变,所以需该溶液的体积为V=1mol/L×0.5L2mol/L=0.25L,故答案为:0.25L;?
③因②中Cl-的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl-的物质的量浓度为1mol/L,H+的物质的量浓度也为1mol/L,
HCl的物质的量为:1mol/L×0.5L=0.5mol,体积为0.5mol×22.4L/mol=11.2L,故答案为:1mol/L;11.2L.
本题解析:
本题难度:一般