时间:2020-07-08 01:42:39
1、计算题 (6分)将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据计算
(1) 原合金中镁和铝的质量。
(2) 盐酸的物质的量浓度。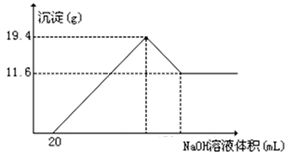
参考答案:(1)根据图像可知,盐酸是过量的。其中氢氧化镁是11.6g,物质的量是0.2mol;氢氧化铝是19.4g-11.6g=7.8g,物质的量是0.1mol
所以根据原子守恒可知,镁和铝的物质的量分别是是0.2mol和0.1mol
因此质量分别是0.2mol×24g/mol=4.8g、0.1mol×27g/mol=2.7g
(2)Mg2++2OH-=Mg(OH)2↓
0.2mol? 0.4mol
Al3++3OH-=Al(OH)3↓
0.1mol 0.3mol
所以消耗氢氧化钠是0.7mol
与过量盐酸的氢氧化钠是5mol/L×0.02L=0.1mol
所以根据原子守恒可知,生成氯化钠是0.8mol
则盐酸的浓度是0.8mol÷0.1L=8mol/L
则溶解氢氧化铝的方程式可知
本题解析:考查化学反应中的有关计算。
本题难度:一般
2、选择题 向含1 mol HCl和l mol MgSO4?的混合溶液中加入1 mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是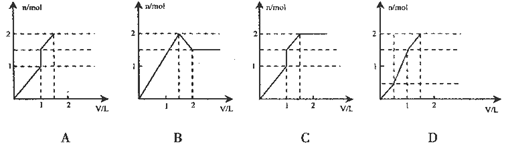
参考答案:D
本题解析:含1 mol HCl和l mol MgSO4?的混合溶液中加入1 mol/L的Ba(OH)2溶液,当加入1L时,溶液中的硫酸根离子全部转化为硫酸钡沉淀,同时HCL全部反应,同时还有氢氧化镁沉淀0.5mol,即当加入1LBa(OH)2溶液后生成沉淀为1.5mol,再加入Ba(OH)2溶液则镁离子继续反应生成氢氧化镁沉淀0.5mol,且最后沉淀质量不再变化;
综上所述,正确选项为D;
本题难度:一般
3、填空题 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
①该反应的平衡常数表达式为:K=_______________;
②该温度下,在2L盛有粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为________________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①____________________________;②____________________________。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是______________。
a.
b.
c.
d.
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:_____________________________;欲使上述体系中浓度增加,可加入的物质是__________________________。
参考答案:(1) ;0.015mol/(L·min)
;0.015mol/(L·min)
(2)①CO或(CO2)的生成速率与消耗速率相等;②CO(或CO2)的质量不再改变
(3)b
(4) ;盐酸
;盐酸
本题解析:
本题难度:一般
4、实验题 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+?=□Fe(OH)3↓+□C1-+?
②检验滤液B中是否还含有铁元素的方法为:??(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为?(填代号)。
a.氢氧化钠溶液? b.硫酸溶液? c.氨水? d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、?(填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O
①正极反应式为?。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的?
原因之一,电极被腐蚀的离子方程式为?。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是?。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为?(填代号)。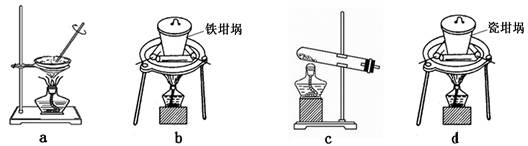
参考答案:(14分)(1)①2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+(2分)
②取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
(其他合理答案均得分)(2分)?③ c(1分)?④过滤(1分)
(2)①HO2-+2e-+H2O=3OH-(2分)?②2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(3)氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气(2分)?(4)b(2分)
本题解析:(1)①根据方程式可知,铁元素的化合价从+2价升高到+3价,失去1个电子。氯元素的化合价从+1价,降低到-1价,得到2个电子,则根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是2:1。根据原子守恒与电荷守恒可知,反应前有水参加,反应后有氢离子生成,因此配平后的方程式是2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+。
②由于铁离子能和KSCN溶液发生显色反应,可以鉴别铁离子。而亚铁离子检验还原性,能被氯水氧化生成铁离子,据此可以鉴别滤液B是否含有铁元素。即取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
③滤液B中的铝元素以Al3+的形式存在,要以沉淀形式析出,需要加入碱液。由于氢氧化铝是两性氢氧化物,所以不能选择强碱,最好选择弱碱氨水,答案选c。
④冷却结晶后有晶体析出,因此分离出晶体的实验操作应该是过滤。
(2)①原电池中负极,失去电子,正极得到电子。则根据方程式2Al+3HO2-=2AlO2-+OH-+H2O可知,负极是铝失去电子,正极是HO2-得到电子,所以正极的电极反应式是HO2-+2e-+H2O=3OH-。
②金属铝能被氢氧化钠溶液溶解,生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)铝是活泼的金属,金属活动顺序表中位于氢的前面,在氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气,Al3+不放电,得不到金属铝。
(4)a是蒸发。不能熔融二氧化硅和氢氧化钠,不正确;b是铁坩埚,可以熔融二氧化硅和氢氧化钠,正确;c是试管,不能熔融二氧化硅和氢氧化钠,不正确;d是瓷坩埚,瓷坩埚中含有二氧化硅能和氢氧化钠反应,不能熔融氢氧化钠,不正确,答案选b。
本题难度:一般
5、选择题 在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.9mol/L
参考答案:C
本题解析:设体积均为1L,铝离子的物质的量是x。由于生成沉淀完全溶解,所以反应为
Al3++4OH-=AlO2-+2H2O
1? 4
x?0.4mol
即
解得x=0.1mol
即含有0.1molAl3+
原溶液中只含有K+,Al3+和SO42-,根据电荷守恒
则n(K+)+3n(Al3+)=2n(SO42-)
而n(Al3+)=0.1mol,n(SO42-)=0.4mol
所以n(K+)+3×0.1mol=2×0.4mol
解得n(K+)=0.5mol
而反应时KOH又引入了0.4molK+
所以K+总量为0.9mol
此时溶液体积变为2L
故c(K+)=0.45mol/L,故选:C。
本题难度:一般