时间:2020-07-08 01:41:25
1、选择题 在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是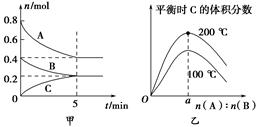
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
参考答案:B
本题解析:A、200 ℃时,反应从开始到平衡B的浓度减少0.2mol/2L=0.1mol/L,所以平均速率v(B)=0.1mol/L/5min=0.02mol·L-1·min-1,错误;B、根据图中数据可知该反应的化学方程式为2A(g)+B(g) C(g)。200℃时,A、B、C的平衡浓度分别是0.2mol/L、0.1mol/L、0.1mol/L,根据化学平衡常数的定义得K=0.1mol/L/0.1mol/L×(0.2mol/L)2="25" L2/mol2,正确;C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,错误;D、由图乙可知温度升高,C的体积分数增大,说明升高温度,平衡正向移动,正向为吸热反应,ΔH>0,a值不确定,错误,答案选B。
C(g)。200℃时,A、B、C的平衡浓度分别是0.2mol/L、0.1mol/L、0.1mol/L,根据化学平衡常数的定义得K=0.1mol/L/0.1mol/L×(0.2mol/L)2="25" L2/mol2,正确;C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,错误;D、由图乙可知温度升高,C的体积分数增大,说明升高温度,平衡正向移动,正向为吸热反应,ΔH>0,a值不确定,错误,答案选B。
本题难度:一般
2、选择题 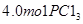 和
和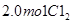 充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)
充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)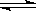 PCl5(g),达平衡时,
PCl5(g),达平衡时,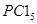 为0.80 mol,如果此时移走2.0 mol
为0.80 mol,如果此时移走2.0 mol 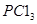 和1.0 mol
和1.0 mol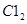 ,在相同温度下再达平衡时,
,在相同温度下再达平衡时,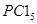 的物质的量是?(?)
的物质的量是?(?)
A.大于0.40 mol,小于 0.80 mol
B.0.40 mol
C.小于0.40 mol
D.0.80 mol
参考答案:C
本题解析:PCl3(g)+Cl2(g)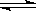 PCl5(g)
PCl5(g)
初始态: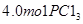 和
和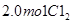 ,达平衡时:
,达平衡时: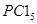 为0.80 mol;
为0.80 mol;
“移走2.0 mol 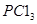 和1.0 mol
和1.0 mol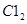 ”,相当于将初始态变为:2.0 mol
”,相当于将初始态变为:2.0 mol 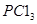 和1.0 mol
和1.0 mol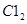
若平衡不移动,则达平衡时: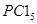 应为0.40 mol;但实际上“移走
应为0.40 mol;但实际上“移走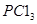 和
和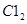 ”的同时,压强减小,上述平衡将逆向移动,故
”的同时,压强减小,上述平衡将逆向移动,故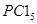 的物质的量减小,小于0.40 mol
的物质的量减小,小于0.40 mol
本题难度:一般
3、填空题 (7分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为VL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g) 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答:
2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V?L。请回答: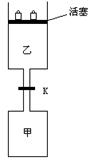
(1)乙中B的转化率为 ?。
(2)甲中D和乙中C的物质的量比较:?(填“相等”、“前者大”、“后者大”)。
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为?(用含V的代数式表示,连通管中气体体积忽略不计)。
参考答案:
(1)60℅(2分)
(2)前者大(2分)?
(3)0.815V(3分)
本题解析:
(1)利用方程式进行计算:
3A(g)+2B(g) 2C(g)+4D(g)
2C(g)+4D(g)
n(初) 3mol? 7mol
Δn? 9a mol? 6a mol?6a mol? 12a mol
n(末)(3-9a) mol (7-6a)mol ?6a mol? 12a mol
所以:(3-9a+7-6a+6a+12a)/10=12.1,a="0.7" ,则B的转化率为 6a/7=60%
(2)转根据等效平衡的原则,乙中反应物的量为甲中的两倍,但是乙的平衡状态中各物质的量小于甲的两倍,并且乙中加压使平衡逆移动,所以乙中C的物质的量比甲中D的物质的量小。
(3)甲乙混合后,与乙的平衡状态Ⅰ为等效平衡。以60%的转化率来计算甲剩余的气体体积。则乙的体积为0.815V。
点评:本题以常见的活塞做模型,配以简单的化学计算,最后一空需对等效平衡进行理解。。
本题难度:一般
4、选择题 可逆反应2SO2+O2 2SO3正反应速率分别用υ(SO2)、υ(O2)、υ(SO3)[mol/(L·min)]表示,逆反应速率分别用υ"(SO2)、υ"(O2)、υ"(SO3)、[mol/(L·min)]表示。当反应达到化学平衡时,正确的关系是(?)
2SO3正反应速率分别用υ(SO2)、υ(O2)、υ(SO3)[mol/(L·min)]表示,逆反应速率分别用υ"(SO2)、υ"(O2)、υ"(SO3)、[mol/(L·min)]表示。当反应达到化学平衡时,正确的关系是(?)
A.υ(O2)=υ(SO2)=υ(SO3)
B.υ(SO3)=υ"(SO2)
C.υ"(O2)=1/2υ"(SO2)
D.υ"(SO2)=υ"(SO3)=υ"(O2)
参考答案:B
本题解析:当反应达到化学平衡时,正、逆反应速率相等。
本题难度:一般
5、选择题 在一个固定容积的密闭容器中,可逆反应N2+3H2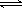 2NH3达到平衡的标志是
2NH3达到平衡的标志是
A.v(N2)正= v(NH3)逆
B.单位时间内3 mol H-H断键反应,同时2 mol N-H也断键反应
C.n(N2): n(H2):n(NH3) ="1" : 3 : 2
D.反应混合物各组分的物质的量浓度不再改变
参考答案:D
本题解析:可逆反应达到平衡的本质为:体系中各组分的浓度保持不变、正逆反应速率相等;
A错,平衡时.2 v(N2)正= v(NH3)逆;B错,平衡时单位时间内3 mol H-H断键反应,同时6 mol N-H也断键反应;C错,平衡时各组分的物质的量不一定与化学计量数成比例;D正确;
本题难度:简单