时间:2020-07-08 01:38:37
1、选择题 现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
[? ]
A.产生的气体是0.2molNO2?
B.硝酸的物质的量浓度为12mol/L?
C.反应中被还原和未被还原的硝酸物质的量之比为3:2?
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol?
参考答案:D
本题解析:
本题难度:一般
2、选择题 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和PbSO4,则参加反应的Cr3+与PbO2的个数之比为
A.1:3
B.2:3
C.1:1
D.4:3
参考答案:B
本题解析:试题分析:根据已知信息可知,铅元素的化合价从+4价降低到+2价,得到2个电子。Cr元素的化合价从+3价升高到+6价,失去3个电子,则依据电子的得失守恒可知,参加反应的Cr3+与PbO2的个数之比为2:3,答案选B。
考点:考查氧化还原反应的有关计算
点评:该题是基础性试题的考查,试题注重基础,难易适中。该题的关键是准确判断出元素化合价的变化情况,然后依据电子得失守恒直接列式计算即可,难度不大。
本题难度:困难
3、选择题 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
A.还原荆是含CN-的物质,氧化产物只有N2
B.氧化剂足ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2(标准状况).则转移电子0.5mol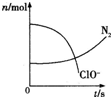
参考答案:C
本题解析:
本题难度:一般
4、选择题 在反应2NH3+3Cl2═6HCl+N2中,氧化剂和还原剂的物质的量之比为( )
A.1:3
B.1:2
C.2:3
D.3:2
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知镁和稀硝酸反应时,当有1molHNO3参加反应,就有0.8mol的电子转移,此时硝酸的还原产物可能是( )
①NO2;②NO;③N2O;④NH4NO3.
A.只有①
B.只有②
C.只有②或③
D.只有③或④
参考答案:1mol硝酸反应,反应中硝酸表现为酸性和氧化性,转移电子0.8mol,则应生成0.4molMg(N03)2,
如有0.2mol硝酸还原,则由0.2mol×(5-x)=0.8mol可知x=1,应生成NO,
如生成硝酸铵,则有0.1mol硝酸还原,由0.1mol×(5-y)=0.8mol可知y=-3,符合题意,
故选D.
本题解析:
本题难度:简单