时间:2020-07-08 01:37:36
1、选择题 已知破坏1 mol H—H键、Cl—Cl键分别需要吸收436kJ、243kJ能量,形成1molH—Cl键放出432kJ能量,则由H2与Cl2生成1 mol HCL总的过程需要(?)
A.放热185kJ
B.吸热185kJ
C.放热92.5kJ
D.吸热92.5kJ
参考答案:C
本题解析:反应热就是断键吸收的能量和形成新键所非常能量的差值,因此该反应的反应热是△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185KJ/mol,因此是放热反应,所以生成1 mol HCl所放出的能量是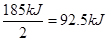 ,因此答案是C。
,因此答案是C。
本题难度:一般
2、选择题 下列各组变化中,化学反应的热量变化(△H或Q)前者小于后者的一组是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
②2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+
| 1 2 |
参考答案:①甲烷燃烧生成液体水放热大于甲烷反应生成气体水;焓变包含负号比较;△H1<△H2
②氢气和氧气反应相同条件下量不同反应热不同;焓变包含负号比较△H1<△H2
③恒容容器中反应进行过程中压强减小,恒压容器中反应过程中压强比恒容容器中大反应物转化率大;△H1<△H2
④碳酸钙吸热,氧化钙和水反应放热;焓变包含负号比较;△H1>△H2
综上所述:①②③符合;
故选A.
本题解析:
本题难度:简单
3、选择题 已知700K时,N2+3H2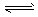 2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是
2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是
[? ]
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是?
[? ]
A.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同
B.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应放热,△H>0
C.已知C(s)+1/2O2(g)=CO(g);?△H?=-110.5kJ·mol-1,则碳的标准燃烧热是△H?=-110.5kJ·mol-1
D.新能源应具有资源丰富、可再生、无污染或少污染等特点。如太阳能、氢能、风能、地热能、潮汐能和生物质能等新能源
参考答案:D
本题解析:
本题难度:一般
5、选择题 化学反应:
C(s)+1/2O2(g) == CO(g) △H1<0
CO(g) +1/2O2(g) == CO2(g) △H2<0
C(s)+O2(g) == CO2(g) △H3<0;
下列说法不正确的是(相同条件下)?
[?]
参考答案:B
本题解析:
本题难度:一般