时间:2020-07-08 01:35:25
1、选择题 下列物质性质变化的比较,正确的是( )
A.原子半径大小:Al>Mg>Na
B.碱性强弱:KOH>NaOH>LiOH
C.气态氢化物稳定性:HBr>HCl>HF
D.还原性强弱:F->Cl->Br->I-
2、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知A、C、F3种原子的最外层共有11个电子,且这3种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。?
(1)写出下列元素的符号:A__,D___,E__。?
(2)B的单质在F的单质中燃烧的现象是_________?,化学方程式是___。?
(3)A、C两种元素最高价氧化物对应的水化物反应的离子方程式是____。
3、简答题 用下面各组物质序号填空:
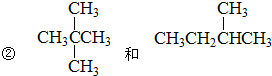

④金刚石和石墨
⑤H、D、T;
⑥2,2-二甲基丙烷和新戊烷
| 类?别 | 同位素 | 同素异形体 | 同分异构体 | 同系物 | 同一种物质 序?号 ______ ______ ______ ______ ______ 4、推断题 现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和;C为常见金属,其最高价氧化物的水化物能分别跟B和D的最高价氧化物的水化物反应。请回答: 5、推断题 (二选一)【物质结构】 |