时间:2020-07-08 01:31:54
1、实验题 (6分)填空题:
(1)(2分)下列实验操作不正确的是?(填字母代号)。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯。
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。
C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。
D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集60℃~150℃馏分得到汽油。
(2)(2分)? 的单体为___________?
的单体为___________?
维通橡胶是一种耐腐蚀、耐油、耐高潮、耐寒性能都特别好的氟橡胶。它的结构简式为: ?合成它的单体为________________________
?合成它的单体为________________________
2、实验题 某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空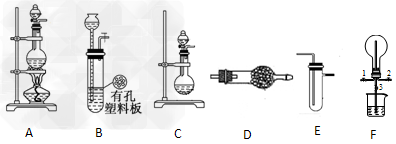
Ⅰ、探究氯气与?氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用_____。
a.碱石灰? b.氯化钙? c.五氧化二磷? d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是_________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3→N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现?浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子___________________。
Ⅱ、探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 __________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是______。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。请设计实验检验反应后F的烧瓶中可能剩余气体的成分。
__________________________
3、选择题 配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是(?)
A.容量瓶使用前有少量蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面
D.俯视确定凹液面与刻度线相切
4、选择题 由实验事实得出的结论,其中正确的是
| ? | 实验事实 | 结论 |
| A | NH3的水溶液能导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3 >HClO |
| D | Na2SiO3溶液中滴入盐酸,产生白色沉淀 | 非金属性:Cl>Si |
5、实验题 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。 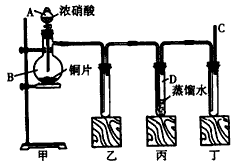
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是___________,该装置中发生反应的化学方程式为______________________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________、___________,装置丙中的试管内发生反应的离子方程式为_____________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为___________色。