时间:2020-07-08 01:28:26
1、选择题 NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1mol过氧化氢分子中共用电子对数为3NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,22.4LSO3中含有的氧原子数为3NA
D.1molNa2O2与CO2充分反应转移的电子数为2NA
参考答案:A.过氧化氢的电子式为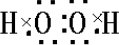
,由电子式可知,1mol过氧化氢分子中共用电子对数为3NA,故A正确;
B.常温常压下,Vm≠22.4L/mol,22.4L的D2、H2组成的气体的物质的量不能与1mol,故B错误;
C.标准状况下SO3为固体,Vm≠22.4L/mol,无法计算O原子的物质的量,故C错误;
D.1molNa2O2与CO2充分反应,电子转移的方向和数目为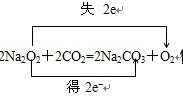
,则1molNa2O2与CO2充分反应转移的电子数为NA,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 NA表示阿佛加德罗常数。下列说法中正确的是
[? ]
A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B.在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
C.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
D.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
参考答案:D
本题解析:
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数,下列说法正确的是?
[? ]
A.?只有在标准状况下NA个氧气分子的物质的量才是1mol ?
B.?浓度为1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA ?
C.?常温常压下,22.4?L?N2气体的分子数小于NA ?
D.?22g?T2O所含的中子数为9NA
参考答案:B
本题解析:
本题难度:简单
4、选择题 NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molMgCl2中含有的离子数为2NA
B.100?mL?2.0?mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.0.1mol/L稀硫酸中含SO42-?的数目为0.1NA
D.标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
参考答案:A、1molMgCl2中含有的离子数为3NA,故A错误;
B、醋酸是弱酸,存在电离平衡;100 mL 2.0 mol/L的盐酸中氢离子均为0.2NA,100 mL 2.0 mol/L的醋酸溶液中氢离子小于0.2NA,故B错误;
C、溶液体积未知,不能计算微粒数;故C错误;
D、标准状况下,11.2LNO物质的量为0.5mol,5.6LO2物质的量为0.25mol,混合后发生反应,2NO+O2=2NO2,生成二氧化氮0.5mol,二氧化氮聚合为四氧化二氮,分子总数小于0.5NA,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 设NA代表阿佛加德罗常数,下列说法正确的是( )
A.23g金属钠变为过氧化钠时失去的电子数为NA
B.18g水所含的电子数目为NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.32g氧气所含的原子数目为NA
参考答案:A.23g钠的物质的量为1mol,钠原子失去1个电子变为钠离子,故1mol金属钠变为钠离子时失去的电子数为NA,故A正确;
B.18g水的物质的量为1mol,一个水分子含有10个电子,18g水所含的电子数目为1mol×10×NAmol-1=10NA,故B错误;
C.气体摩尔体积与状态有关,常温常压下无法求出气体的物质的量,故C错误;
D.32g氧气的物质的量是1mol,所含的原子数目为2NA,故D错误.
故选A.
本题解析:
本题难度:简单