时间:2020-07-08 01:26:23
1、选择题 0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-) B.c(H+)>c(HA) C.c(OH-)>c(HA) D.c(HA)>c(A-)
参考答案:AD
本题解析:c(酸)= 0.1 mol/L,pH=2,c(H+)=0.01mol/L< c(酸).所以该酸是弱酸。A. 在溶液中除了存在酸的电离平衡HA H+ +A-,外还存在水的电离平衡:H2O
H+ +A-,外还存在水的电离平衡:H2O H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
考点:考查弱电解质溶液中各种微粒的浓度的关系的知识。
本题难度:一般
2、填空题 (6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖
(用编号回答)其中属于弱电解质的有?;属于强电解质的有?;强电解质在水中?电离。
参考答案:①②;④⑤;完全(几乎完全;全部)
本题解析:略
本题难度:简单
3、选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH="5" V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
参考答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有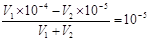 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题难度:简单
4、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是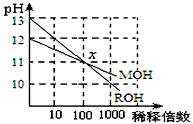
[? ]
A.稀释前,c(ROH) =10 c(MOH)
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.MOH是一种弱碱
参考答案:A
本题解析:
本题难度:一般
5、选择题 常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
| 实验编号 | c(HA)/ mol·L-1 | c(NaOH)/ mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
参考答案:
本题解析:
本题难度:一般