时间:2020-07-08 01:22:54
1、选择题 有关下图所示化合物的说法不正确的是 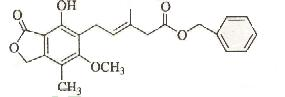
A.既可以催化加氢
B.又可以使酸性KMnO4溶液褪色
C.1mol该化合物最多可以与3molNaOH反应
D.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
E.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
2、选择题 理论与事实相结合,是学习化学的重要方法,现有:FeS+2HCl=FeCl2+H2S↑,CuSO4+H2S=CuS↓+H2SO4,这二个反应在常温下都能进行.通过以上实验,下列结论可能不合理的
A.CuS不溶于强酸,FeS可溶于强酸
B.CuS比FeS的溶解度更小
C.H2S液中电离出的S2-浓度相当大
D.转化成CuS是放热反应
3、选择题 分子式为C8H10O的苯的衍生物,其分子中含有两个互为对位的取代基,则其中不与NaOH?溶液反应的物质的种数为
A.1个
B.2个
C.3个
D.4个
4、选择题 不洁净玻璃仪器洗涤方法正确的是
A.做银镜反应后的试管用氨水洗涤
B.做碘升华实验后的烧杯用酒精洗涤
C.盛装苯酚后的试管用盐酸洗涤
D.实验室制O2后的试管用稀HCl洗涤
5、选择题 下列叙述正确的是
A.在氧化还原反应中,做氧化剂的物质不能做还原剂
B.分解反应都是氧化还原反应
C.反应中某元素的原子变为阳离子,则该元素的单质在反应中一定被还原
D.凡是没有电子转移也就没有化合价升降的反应,就不属于氧化还原反应