时间:2020-07-08 01:20:43
1、实验题 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A.B.C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL
6mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤.小心烘干.称量。将B.C重复上面的实验。
(1)锌镀层完全反应的标志是________________________________
(2)如何检验铁片已经洗净?________________________________
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为Scm2.质量为mg的镀锌铁皮放入
6mol·L-1 NaOH溶液中。回答下列问题: 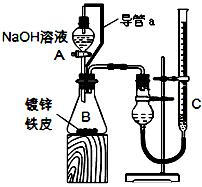
(3)装置中导管a的作用是________________________________
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温;
③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是__________________(填序号)。
参考答案:(1)反应速率突然减小
(2)取最后一次洗出液,滴加AgNO3溶液,若无白色沉淀,则铁片已洗净(或用玻璃棒蘸取最后一次洗出液,滴在蓝色石蕊试纸上,若不变红色,则铁片已洗净)
(3)使分液漏斗和锥形瓶内气压相同,NaOH溶液能顺利滴下
(4)④①③②④①
本题解析:
本题难度:困难
2、填空题 (10分)(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。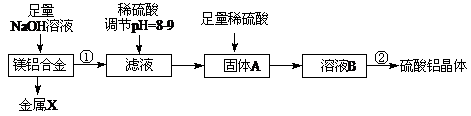
则镁铝合金中加NaOH溶液的化学反应方程式为?▲?,
金属X是?▲?,固体A的化学式?▲?,操作②包含的步骤有蒸发浓缩、?▲?、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称?▲?,需要测定的数据有?▲?。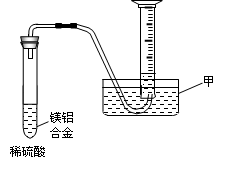
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
的物质的量之和为0.10 mol,若向此溶液加入170 mL? 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为?▲?mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。?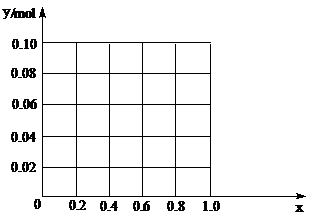
参考答案:(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑, Mg, Al(OH)3 ,冷却结晶(降温结晶)(4分)(2)水槽 ,氢气的体积、镁铝合金的质量(温度、大气压强)答(到前2个条件给满分)。
(1+2分,共3分)
(3)0.06mol?如图(1+2分,共3分)
本题解析:略
本题难度:一般
3、实验题 (20分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、?、?、
?等(只需答出三种仪器即可);
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式:?;
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:?。
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(O H)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
H)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]:?(填“猜想I成立”或“猜想I不成立”);
[猜想II]:主要成分为氯化锌;
[验证(操作)过程]:?;
[实验现象]:?;
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:
操作②的滤液中的主要成分为:?;次要成分为:?。
参考答案:(20分)⑴坩埚、三角架、泥三角(或坩埚钳等只需答出三个)
⑵2H2O2 ?2H2O + O2↑
?2H2O + O2↑ ?⑶炭 (或碳、或C、或淀粉)
?⑶炭 (或碳、或C、或淀粉)
⑷ [判断猜想]:猜想I不成立
[验证(操作)过程]:取少量滤液逐滴滴入稀氨水
[实验现象]:先有白色沉淀、滴入过量稀氨水后白 色沉
色沉 淀溶解;
淀溶解;
[判断猜想]:主要为氯化锌,次要为氯化铵
本题解析:略
本题难度:一般
4、选择题 由实验事实得出的结论,其中正确的是
| ? | 实验事实 | 结论 |
| A | NH3的水溶液能导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3 >HClO |
| D | Na2SiO3溶液中滴入盐酸,产生白色沉淀 | 非金属性:Cl>Si |
参考答案:C
本题解析:略
本题难度:一般
5、简答题 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n?XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产的工艺流程如下: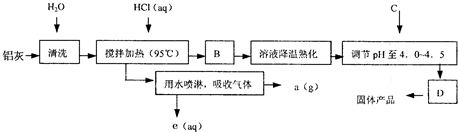
(1)搅拌加热操作过程中发生反应的离子方程式为:______;______.
(2)生产过程中B和D的操作名称分别是______和______(B和D均为简单操作).
(3)反应中副产品a是______.
(4)生产过程中可循环使用的物质是______(用化学式表示).
(5)调节pH至4.0~4.5的目的是______.
(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程C物质可选用______.
A.NaOH? B.Al? C.氨水? D.Al2O3 E.NaAlO2.
参考答案:(1)氧化铝与盐酸反应生成氯化铝和水,反应离子方程式为Al2O3+6H+=2Al3++3H2O;
铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑;
(2)铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体,所以生产过程中操作B和D的均为过滤.
故答案为:过滤、过滤;
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,有氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气,反应中副产品a为H2.
故答案为:H2.
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),可进行循环使用.
故答案为:HCl;
(5)铝离子水解,Al3++3H2O?Al(OH)3+3H+,降低氢离子浓度促进铝离子水解,有利于聚合氯化铝晶体析出.
故答案为:促进AlCl3水解,使晶体析出;
(6)用氢氧化钠和氨水调节pH值,会引入新的杂质,引入钠离子和铵根离子.所以可以加入Al和氧化铝进行处理,它二者是固体,多了可以过滤掉的,所以可以使得到的晶体较纯净.
故答案为:BD.
本题解析:
本题难度:一般