时间:2020-07-08 01:19:18
1、填空题 本题含两小题,共14分。
(1)(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。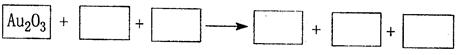
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)(6分)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
2、填空题 21在Fe + 2HCl ="=" FeCl2(氯化亚铁) + H2↑ 反应中。
② 此反应若转移了12mol的电子,则生成氢气 L(标准状况下).
3、选择题 向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2
D.1mol Fe可还原2mol Fe3+
4、填空题 (1)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O Al(OH)4- +H+?②NH3+H2O
Al(OH)4- +H+?②NH3+H2O NH4++OH-
NH4++OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式?
(B)已知N2H4是二元弱碱,试写出其二步电离方程式??
?。
(2)将a mol Cl2通入含 b mol FeBr2的溶液中,若0<a/b≤1/2时,反应的离子方程式为2Fe2+ +Cl2 = 2Fe3+ +2 Cl-,写出另2个可能发生的离子方程式。
①当1/2< a/b<3/2时?。
②当a/b≥3/2时?。
5、选择题 已知反应①2BrO3- + Cl2 =Br2 +2ClO3-
②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,
下列有关氧化(还原)能力强弱顺序正确的是 ?(?)
A.还原性:Cl->I2>Br2>Cl2
B.还原性:Cl->I2>Cl2>Br2
C.氧化性:BrO3->ClO3->Cl2>IO3-
D.氧化性:Cl2>BrO3->C1O3->IO3-