时间:2020-07-08 01:16:21
1、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知: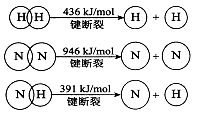
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。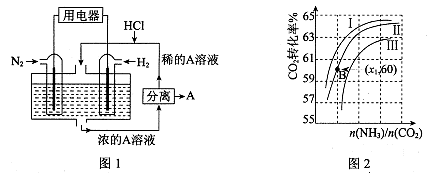
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比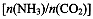 、水碳比
、水碳比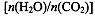 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
参考答案:(13分)
(1)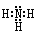 (2分)
(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+ (2分) NH4Cl (2分)
(4)Ⅲ (1分); 3 (2分)
本题解析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是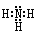
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
考点:考查电子式、热化学方程式、电极反应式的书写,平衡移动的判断,化学平衡常数的判断,对图像的分析能力
本题难度:困难
2、选择题 据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是 H+。下列对该燃料电池的描述中正确的是
[? ]
①正极反应为:O2+4H++4e-=2H2O
②负极反应为:2H2 -4e-=4H+
③总的化学反应为:2H2+O2 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③
B.②③④
C.①②④
D.①②③④
参考答案:C
本题解析:
本题难度:一般
3、选择题 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍,且更安全。电池总反应为:C2H5OH+3O2 = 2CO2+3H2O,电池示意如下图,下列说法不正确的是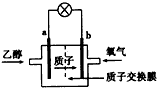
[? ]
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1 mol 乙醇被氧化时就有6 mol 电子转移
参考答案:D
本题解析:
本题难度:一般
4、填空题 (10分)Zn-Cu-H2SO4原电池的负极材料是是 ,正极反应式是 ,发生 反应(填反应类型),总反应式为___________________________________。
参考答案:Zn 2H++2e-=====H2↑ 还原反应 Zn+2H2SO4=====ZnSO4+2H2↑(10分)
本题解析:活泼金属做负极,相对不活泼的金属做正极,总反应Zn+2H2SO4=====ZnSO4+2H2↑
本题难度:一般
5、选择题 关于如图所示的原电池,下列说法正确的是( )
A.电子从铜电极通过电流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-=H2↑
参考答案:A.原电池工作时,锌为负极,铜为正极,电子从锌电极通过检流计流向铜电极,故A错误;
B.溶液中阳离子向正极铜电极移动,阴离子向负极移动,故B正确;
C.锌失电子发生氧化反应,铜离子得电子发生还原反应,故C错误;
D.铜为正极,发生还原反应,电极反应为Cu2++2e-=Cu,故D错误.
故选B.
本题解析:
本题难度:一般