时间:2020-07-08 01:15:39
1、选择题 制备单质硅时,主要化学反应如下
①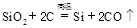 ? ②
? ②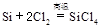 ? ③
? ③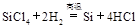 下列对上述三个反应的叙述中,不正确的是( ?)
下列对上述三个反应的叙述中,不正确的是( ?)
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被氧化
参考答案:D
本题解析:1、三个反应都是置换反应,反应前后都有单质生成。2、三个反应都是氧化还原反应,因为都有化合价的变化。3、②反应属于化合。4、①③反应中硅元素价态降低,做氧化剂,被还原,但是②中硅元素价态升高,做还原剂,被氧化。
点评:本题涉及到了置换反应和化合反应的辨析,主要抓住反应的特点。另外要熟记氧化还原的特征和规律,分清还原剂和氧化剂。
本题难度:简单
2、选择题 下列叙述中能肯定A金属比B金属金属性强的是? (? )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
参考答案:D
本题解析:A.比较元素金属性的强弱不能通过看原子最外层电子数的多少。错误。B. 比较元素金属性的强弱不能通过看原子核外电子层数的多少。错误。C.比较元素金属性的强弱不能也不能看金属与酸反应置换H2的多少。错误。D.金属活动性的强弱可以通过金属与水或酸置换出氢气的难易。活动性强的能够把水中是氢置换出来,活动性弱的不能把水中的氢置换出来。正确。
本题难度:一般
3、选择题 关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的叙述中,正确的是
A.KCl中含有35Cl
B.生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e-
D.氧化剂和还原剂的物质的量之比为1:6
参考答案:B
本题解析:反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中K35ClO3为氧化剂,H37Cl既作为酸性又作为还原剂且其物质的量之比为1:5,所以
A错,KCl中一定不含有35Cl;B正确,在生成的3mol氯分子中有5个氯为37Cl,有1个氯为35Cl,则生成物Cl2的相对分子质量为73.3;C错,该反应转移的电子数为5e-;D错,氧化剂和还原剂的物质的量之比为1:5
本题难度:简单
4、选择题 向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,可得到剩余的固体物质。已知:Na2SO3+I2+H2O===Na2SO4+2HI,则剩余固体物质的组成可能是
①NaCl、Na2SO4②NaCl、NaBr、Na2SO4③NaCl、Na2SO4、I2④NaCl、NaI、Na2SO4
A.①②
B.②④
C.①③
D.③④
参考答案:A
本题解析:根据题意,物质的还原性顺序是Na2SO3>NaI>NaBr,通入一定量的氯气时,若三种物质完全反应,则剩余NaCl、Na2SO4;若氯气只与前二者反应,则剩余NaCl、NaBr、Na2SO4;若氯气只与亚硫酸钠反应,则剩余物质是NaCl、NaBr、Na2SO4、NaI,因为碘易挥发,所以剩余物质中不可能有碘单质,同时不可能氧化NaBr而NaI有剩余,所以可能剩余的固体成分是①②,答案选A。
考点:考查氯气与物质之间的反应,物质还原性的判断
本题难度:一般
5、选择题 半径由小到大、氧化性由强到弱的一组微粒是
A.H+、Al3+、Mg2+、K+
B.O、P、S、Cl
C.S2-、Cl-、K+、Ca2+?
D.Na、Mg、Al、K
参考答案:A
本题解析:微粒半径判定规则:电子层数越大半径越大,层数相同时,核电荷数越大,半径越小;由些即可排除BCD,答案A符合题意
本题难度:一般