时间:2020-07-08 01:14:14
1、选择题 有一块镁铝合金,其中镁与铝的质量比是8:9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是(?)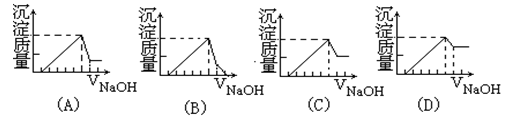
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下面是实验室制取氨气的装置和选用的试剂,其中错误的是?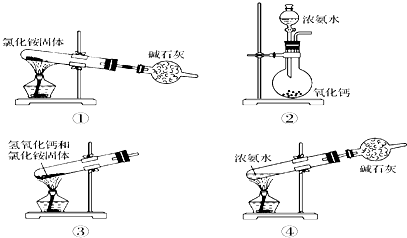
A.①②
B.②③
C.③④
D.①③
参考答案:D
本题解析:分析:①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
②CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
③固体加热制气体时,试管口应略向下倾斜;
④根据浓氨水易挥发,可用碱石灰干燥分析.
解答:实验室制备氨气是利用氯化铵和氢氧化钙固体加热制取,化学方程式为2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2,
2NH3↑+2H2O+CaCl2,
①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故①错误;
②向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故②正确;
③固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,所以利用氯化铵和氢氧化钙固体加热制取氨气需试管口应略向下倾斜,故③错误;
④浓氨水易挥发,用浓氨水加热制取NH3的方法是正确的,氨气是碱性气体,可用碱石灰干燥,故④正确;
故选D.
点评:本题考查氨气的实验室制备,掌握氨气的制备原理和化学性质是解答的关键,题目难度不大.
本题难度:简单
3、选择题 下列图像表示Al3+与AlO2-物质的量变化的曲线,实线表示Al3+,虚线表示AlO2-,其中正确的是?
[? ]
A.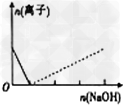
B.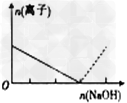
C.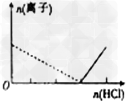
D.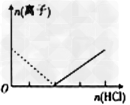
参考答案:B
本题解析:
本题难度:一般
4、选择题 为了除去铁粉中的少量铝粉,可以选用的试剂是
A.稀盐酸
B.稀硫酸
C.氯化铜溶液
D.氢氧化钠溶液
参考答案:D
本题解析:铝和铁都属于活泼的金属,都能和酸反应,且都能发生钝化。但铝还能溶于氢氧化钠溶液中,因此要除去铁粉中的少量铝粉,可以选取氢氧化钠溶液,答案选D。
点评:该题表面分析是物质的分离和提纯,实际是考查金属的化学性质。另外物质的分离和提纯也主要是依据物质的性质特别是化学性质选择适当分离和提纯的方法。
本题难度:一般
5、简答题 将Fe和Al按一定的质量比组成合金.
(1)取一定量的该合金,向其中加入足量NaOH溶液,生成气体n?L(标准状况),则反应的离子方程式是______,合金中Al的物质的量是______.
(2)另取相同质量的该合金,向其中加入足量稀硫酸,固体全部溶解,生成气体m?L?(标准状况),则反应中转移电子的物质的量是______?mol,合金中Fe的质量是______.
(3)向(2)所得溶液中加入过量NaOH溶液,将产生的沉淀过滤,经洗涤、干燥、灼烧后得到一种固体,该固体质量和原合金的质量相等,则原合金中铝的质量分数是______.
参考答案:(1)铁和氢氧化钠不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
n?L氢气的物质的量=n22.4mol,由方程式可知n(Al)=23n(H2)=23×n22.4mol=n33.6mol,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;n33.6mol;
(2)加入足量的稀硫酸,Fe、Al与硫酸都反应生成氢气,生成氢气的物质的量=m22.4mol,根据电子转移守恒可知,转移电子的物质的量=m22.4mol×2=m11.2mol;
Al生成的氢气体积等于与氢氧化钠反应生成的氢气体积,则Fe与硫酸反应生成氢气的体积为(m-n)L,氢气的物质的量为(m-n)L22.4L/mol=m-n22.4mol,根据电子转移可知n(Fe)=n(H2)=m-n22.4mol,故m(Fe)=m-n22.4mol×56g/mol=2.5(m-n)g,
故答案为:m11.2;2.5(m-n)g;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;n33.6mol;
(3)向(2)所得的溶液加入过量的NaOH溶液,铝离子转化为偏铝酸根,不溶物是氢氧化铁,灼烧后所得固体为氧化铁,测得氧化铁与原混合物的质量恰好相等,则氧化铁中氧元素的质量等于混合物中Al的质量,故原混合物中Al的质量分数等于氧化铁中元素的质量分数为48160×100%=30%,
故答案为:30%.
本题解析:
本题难度:一般