时间:2020-07-08 01:08:48
1、选择题 可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应 ① Br2 + 2e-= 2Br- ② 2Br--2e-= Br2 ③ Zn - 2e-= Zn2+ ④ Zn2+ +2e-= Zn 其中表示充电时的阳极反应和放电时的负极反应的分别是
[? ]
A.②和③
B.②和①
C.③和①
D.④和①
参考答案:A
本题解析:
本题难度:一般
2、简答题 该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾
①电解槽的阳极反应式为______.此时通过阴离子交换膜的离子数______(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)______导出,制得的氧气从出口(填写“A”、“B”、“C”、“D”)______导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因______.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为______.
参考答案:①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;<.
②氢氧化钠在阴极生成,所以在D口导出;氧气在阳极生成,且氧气是气体,所以从B口导出.
故答案为:D,B.
③通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的PH值增大.
故答案为:H+放电,促进水的电离,OH-浓度增大.
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,所以氧气在正极上得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般
3、填空题 Ⅰ.(1)电镀时,镀件与电源的________极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用________(填“氧化剂”或“还原剂”)与之反应。
Ⅱ.尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为________、________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
参考答案:Ⅰ.(1)负 (2)还原剂
Ⅱ.(1)B (2)2Cl--2e-=Cl2↑ CO(NH2)2+H2O+3Cl2=N2↑+CO2↑+6HCl
(3)不变 7.2
本题解析:Ⅰ.(1)电镀时,镀层金属作电解池的阳极,镀件作电解池的阴极,与电源的负极相连。
(2)镀铜是将Cu2+变成Cu,需要加入还原剂与之反应。
Ⅱ.(1)图中产生氢气的电极为阴极,与阴极相连的电极为负极,所以B为负极。
(2)根据信息,阳极上先产生氯气,氯气具有氧化性,尿素中的氮原子为-3价,具有还原性,两者相遇发生氧化还原反应。
(3)反应过程中实际上发生两个反应(条件略去):2NaCl+2H2O 2NaOH+Cl2↑+H2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,两方程式相加消去中间产物可得总反应方程式:CO(NH2)2+H2O=N2↑+CO2↑+3H2↑,由此可知反应的最终结果是没有酸或者是碱生成,阴极室的酸碱性不会发生改变;两极产生的气体是氢气、氮气和二氧化碳,根据化学方程式若设氢气的量为x,氮气和二氧化碳各为
2NaOH+Cl2↑+H2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,两方程式相加消去中间产物可得总反应方程式:CO(NH2)2+H2O=N2↑+CO2↑+3H2↑,由此可知反应的最终结果是没有酸或者是碱生成,阴极室的酸碱性不会发生改变;两极产生的气体是氢气、氮气和二氧化碳,根据化学方程式若设氢气的量为x,氮气和二氧化碳各为 ,则x+
,则x+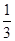 x+
x+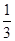 x=
x= ,解得x=0.36 mol。
,解得x=0.36 mol。
m[CO(NH2)2]=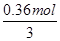 ×60 g·mol-1=7.2 g。
×60 g·mol-1=7.2 g。
本题难度:一般
4、选择题 已知A、B为单质,C为化合物。且有如下转化关系
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液与Na2CO3溶液反应,放出CO2气体,则A可能是H2
③若C溶液中滴加NaOH溶液,先生成沉淀后又溶解,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
参考答案:B
本题解析:①2Na+O2 Na2O2;2Na2O2+2H2O=4Na++4OH-+O2↑;NaOH溶液电解产生H2和O2,不符合转化关系,错误;②H2+Cl2
Na2O2;2Na2O2+2H2O=4Na++4OH-+O2↑;NaOH溶液电解产生H2和O2,不符合转化关系,错误;②H2+Cl2 2HCl;Na2CO3+2HCl=2NaCl+ CO2 ↑ + H2O;HCl溶液电解产生H2和Cl2,正确;③2Al+3Cl2
2HCl;Na2CO3+2HCl=2NaCl+ CO2 ↑ + H2O;HCl溶液电解产生H2和Cl2,正确;③2Al+3Cl2 2AlCl3;AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=NaAlO2+2H2O,AlCl3溶液电解,阳极产生Cl2,阴极产生H2,不符合上述转化关系,错误;④ Cu+Cl2
2AlCl3;AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=NaAlO2+2H2O,AlCl3溶液电解,阳极产生Cl2,阴极产生H2,不符合上述转化关系,错误;④ Cu+Cl2 CuCl2,向CuCl2溶液中加入NaOH溶液产生Cu(OH)2沉淀;电解CuCl2阴极产生Cu,阳极产生Cl2。符合上述转化关系,正确。所以能实现上述转化关系的是②④,选项是B。
CuCl2,向CuCl2溶液中加入NaOH溶液产生Cu(OH)2沉淀;电解CuCl2阴极产生Cu,阳极产生Cl2。符合上述转化关系,正确。所以能实现上述转化关系的是②④,选项是B。
考点:考查物质的性质、转化关系的知识。
本题难度:一般
5、实验题 (12分)课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________
(2)甲装置中电解反应的总化学方程式是____________________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是__________。
(4)欲用丙装置给铜镀银,G应该是___(填“铜”或“银”),电镀液的主要成分是?(填化学式)。
(5)装置丁中的现象是?
参考答案:(1)正极? (2) 2CuSO4+2H2O 2Cu+O2↑+2H2SO4?
2Cu+O2↑+2H2SO4?
(3)1:1?(4)银? AgNO3?(5)Y极附近红褐色变深
本题解析:(1)电解饱和食盐水时,阴极电极反应2H++2e-=H2↑,H+放电破坏了水的电离平衡,使溶液中的c(OH—)>c(H+),溶液呈碱性,使酚酞呈红色,故F极为阴极,对应的外电源B极为负极,A极为正极
(2)电解硫酸铜总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
(3)电解饱和食盐水时,阳极电极反应2Cl—+2e-=Cl2↑,即氢气与氯气的体积相等
(4)在电镀装置中,镀件金属铜为阴极H,镀层金属银为阳极G,电镀液阳离子为镀层金属阳离子,即银离子,可用AgNO3
(5)胶体有电泳现象,Fe(OH)3胶体中胶粒带正电,故胶粒向外电源负极B方向移动,即Y极附近红褐色变深
本题难度:一般