时间:2020-07-08 01:03:31
1、推断题 下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。 请回答下列问题 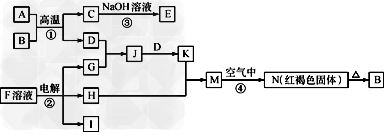
(1)B的化学式为____________。
(2)H的电子式为____________。
(3)写出反应③的离子方程式_____________。
(4)写出反应④的化学方程式_____________。
参考答案:(1)Fe2O3
(2)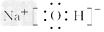
(3)Al2O3+2OH-===2AlO2-+H2O
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3
本题解析:
本题难度:一般
2、简答题 选做题:图表示某些化工生产的流程(部分反应条件和产物略去):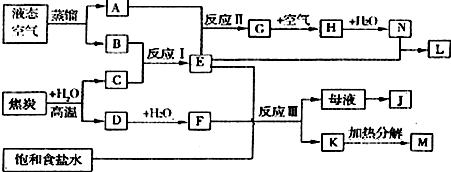
(1)反应I需在500℃进行,其主要原因是______.
(2)H转化为N的过程中,需要不断补充空气,其原因是______.
(3)写出反应Ⅲ的化学方程式______.
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是______(填序号).
a.增大NH4+的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称______.
参考答案:液态空气蒸馏主要得到O2和N2,焦炭和水蒸气在高温下反应生成CO和H2,二者得到的气体B、C在催化剂条件下能发生反应,则应为N2和H2的反应,生成的气体为NH3,所以,A为O2,B为N2,C为H2,D为CO,E为NH3,NH3和O2在催化剂条件下发生氧化还原反应生成NO,NO与反应生成NO2,进而与水反应生成,所以,G为NO,H为NO2,I为HNO3,L为NH4NO3,CO和O2反应生成CO2,CO2、NaCl和NH3反应生成NaHCO3,为侯氏制碱法的主要反应,NaHCO3加热分解生成Na2CO3,则F为CO2,
J为NH4Cl,K为NaHCO3,M为Na2CO3;
(1)反应I是工业合成氨气的反应,需在500~℃进行,其主要原因是此温度下催化剂活性最高;故答案为:此温度下催化剂活性最高;
(2)H转化为N的过程中是二氧化氮和水反应生成硝酸和一氧化氮的反应,反应是化学平衡,需要不断补充空气使一氧化氮气体不断转化为二氧化氮,提高原料的利用率,故答案为:使一氧化氮气体不断转化为二氧化氮,提高原料的利用率;
(3)反应Ⅲ是候氏制碱法的反应原理,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)工业上,向析出K的母液为氯化铵中通氨气,加入细小食盐颗粒,冷却后可析出副产品J氯化铵,通入氨气的作用是增大铵根离子浓度使氯化铵晶体析出,氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;故答案为:ac;
(5)上述流程所涉及的化学工业的名称为:工业合成氨、氨气的催化氧化、侯德榜制碱法;故答案为:工业合成氨、氨气的催化氧化、侯德榜制碱法;
本题解析:
本题难度:一般
3、填空题 (12分)A、B、D均为常见化合物,它们都由两种元素组成,C代表一类化合物;甲、乙、丙都是非金属单质。在一定条件下它们有如下转化关系: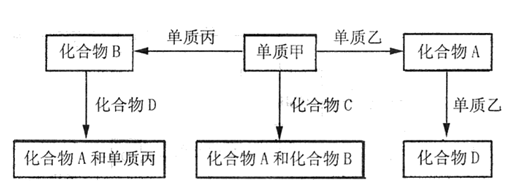
试回答:
(1)单质乙、丙分别为?、?。
(2)化合物A电子式为?、化合物D形成的晶体属于?(填“原子晶体”、“分子晶体”或“离子晶体”)。
(3)单质甲和化合物C反应的化学方程式为?。
(4)化合物的B和化合物D反应的化学方程式为?。
参考答案:(1)碳、氢气?(2)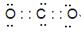 ?分子晶体
?分子晶体
(3)(2分)CxHy+(x+y/4)O2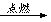 xCO2+y/2H2O
xCO2+y/2H2O
(4)(2分)CO+H2O CO2+H2(每空2分)
CO2+H2(每空2分)
本题解析:甲+乙→A,而A+乙→D,且甲和乙都是非金属单质,所以符号转化的可以是C
+O2→CO,CO+O2→CO2。由于丙也是非金属单质,所以甲应该是氧气,乙是碳,A是
CO2,D是CO。则丙是氢气,B是水,C是碳氢化合物。
本题难度:一般
4、推断题 (7分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
ABCD
请回答下列问题:
(1)若常温下A为淡黄色固体单质,D为强酸,则A、D分别为(填写化学式)A:________,D:________。
写出D→B的化学方程式:____________________________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则A为______________,写出A→B转化的化学方程式:________________________________________________。
参考答案:(1)S? H2SO4?Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)NH3? 4NH3+5O2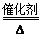 4NO+6H2
4NO+6H2
本题解析:(1)常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸.由硫酸制得二氧化硫,则可以由浓硫酸与铜反应,即
反应为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,故答案为:S;H2SO4;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:S;H2SO4;Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是氨气,则B是一氧化氮,C是二氧化氮,D是硝酸.由氨气制得一氧化氮,是氨气的催化氧化,即4NH3+5O2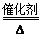 =4NO+6H2O。
=4NO+6H2O。
点评:题把S和氨气以及硫酸、硝酸的制取结合起来,引导学生对S、N两种元素及其化合物的性质进行总结,它启发我们,学习时要善于总结,形成比较系统的知识结构.
本题难度:一般
5、填空题 (10分)下图中A~I分别代表有关反应中的一种物质,其中A为酸式盐,请回答下列问题: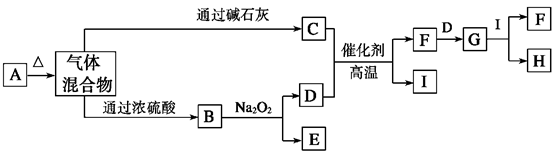 (1)A、F的化学式分别为?、??。?
(1)A、F的化学式分别为?、??。?
(2)I的电子式为?;I的沸点较高的原因是?
(3)E的水溶液中,各离子浓度由大到小的顺序为
?。
(4)写出反应B+Na2O2?→? D+E的化学方程式:
?
(5)指出实验室中保存H的方法及其原因:?
参考答案:(1)NH4HCO3? NO
(2)H? O? H? 存在分子间氢键
(3)c (Na+)>c(CO 32-? )>c(OH-)>c(HCO 3- ?)>c(H+)
(4)2CO2+2Na2O2 =2Na2CO3+O2
(5)硝酸见光或受热容易分解,故通常保存在棕色瓶中并置于冷暗处
本题解析:本题是无机框图题,关键是找准突破点。框图中有两条重要信息:一是B经浓H2SO4干燥后可与过氧化钠反应,可以推知B可能为二氧化碳;二是A为酸式盐,加热后固体完全消失得到混合气体,可以推知A为弱酸酸式铵盐,则C为NH3,C与D能发生催化反应,故D为O2,E为Na2CO3。其余物质依次为A:NH4HCO3,F:NO,I:H2O,G:NO2。H:HNO。
本题难度:一般