时间:2020-07-08 01:02:29
1、填空题 (6分)设水的电离平衡线如右图所示。 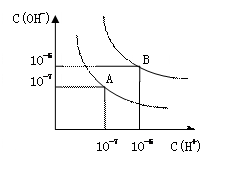
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温
度升高到100℃时,水的电离平衡状态到B点,则此时水的离子
积从___________增加到____________; A
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐
酸的体积比为__________。
2、选择题 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是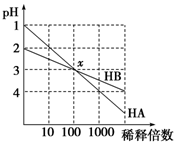
A.HA是一种强酸
B.x点,[A-]=[B-]
C.HB是一种弱酸
D.原溶液中HA的物质的量浓度为HB的10倍
3、选择题 pH="2" 的两弱酸HA.HB加水稀释后,溶液 pH随加水量的变化曲线如图所示。则下列叙述正确的是:(?)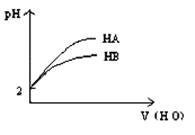
A.电离平衡常数HA > HB
B.等体积等pH的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积等pH的HA和HB 与等质量的Zn反应,HA反应速率大
D.若有等浓度的NaA.NaB,则碱性NaA>NaB
4、填空题 (4分)有H+浓度相同、体积相等的三种酸:a、盐酸? b、硫酸? c、醋酸,同
时加入足量的锌,则开始时反应速率由大到小的顺序是?(用
a、b、c表示), 完全反应后生成H2的体积由大到小是 ??。
5、选择题 已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1。则物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.NaCN
B.NaF
C.CH3COONa
D.NaNO2