时间:2020-07-08 01:01:46
1、选择题 高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
Fe(OH)3+ClO-+OH- 一FeO42-+Cl- +H2O(未配平),在上述反应中(? )
A.FeO42-是还原产物
B.ClO-是还原剂
C.1molFe(OH)3得到3mol电子
D.配平后OH- 的化学计量数为4
2、选择题 下列对氧化还原反应所标出的电子转移情况中没有错误的是
[? ]
A. 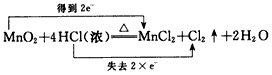
B. 
C. 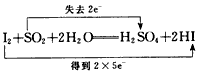
D. 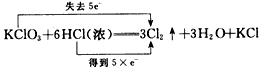
3、选择题 过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等。现向50mL浓度为0.100 mol/L的FeCl2溶液中加入25mL浓度为0.0400 mol/L的KMnO4,在滴加少量的H2SO4后,两者恰好完全反应。则氧化剂KMnO4的还原产物可能为
[? ]
A.K2MnO4
B.MnO2
C.MnCl2
D.Mn
4、选择题 下列氧化还原反应方程式正确的是(?)
A.Fe2++Cl2====Fe3++2Cl-
B.Fe3++Fe====2Fe2+
C.2KMnO4+3H2O2+3H2SO4====K2SO4+2MnSO4+4O2↑+6H2O
D.2KMnO4+5H2O2+3H2SO4====K2SO4+2MnSO4+5O2↑+8H2O
5、选择题 关于反应: 4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是
A.Al是还原剂,TiC是氧化产物
B.TiO2是氧化剂,TiC是还原产物
C.反应中氧化剂与还原剂的物质的量之比是1:1
D.生成1molTiC转移4mol电子