时间:2020-07-08 01:01:05
1、填空题 有下列四种溶液(均无气体逸出) ?
A.0.01mol/L的H2CO3溶液 ?
B.0.01mol/L的NaHCO3溶液 ?
C.0.02mol/L的HCl与0.04mol/L的NaHCO3溶液等体积混合液 ?
D.0.02mol/L的NaOH与0.02?mol/L的NaHCO3溶液等体积混合液
据此,填写下列空白(填代号)?
(1)?c(H+)?最大的是______________;?
(2)?c(H2CO3)?最大的是______________; ?
(3)?c(HCO3-)?最大的是____________;
(4)?c(CO32-)?最大的是_____________?;
(5)?c(HCO3-)?最小的是____________。
参考答案:(1)A?
(2)D
(3)D
(4)C?
(5)A
本题解析:
本题难度:一般
2、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
[? ]
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.KSP(AgCl)>KSP(AgI)由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下,对下列各溶液的叙述不正确的是( )
A.CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
B.在pH=8的NaF溶液中,c(Na+)-c(F-)=9.9×10-7mol/L
C.pH=2的盐酸与pH=12的Ba(OH)2溶液等体积混合后,溶液中一定有c(H+)=c(OH-)
D.向0.1mol/L氨水中加入少量NH4Cl固体,溶液中c(OH-)/c(NH3?H2O)增大
参考答案:A、醋酸钠溶液呈电中性,所以溶液中阴阳离子所带电荷相等,即c(OH-)+c(CH3COO-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COOH),故A正确.
B、常温下,PH=8的NaF溶液中,c(OH-)=10-6 mol/L,c(H+)=10-8 mol/L,根据电荷守恒得c(OH-)+c(F-)=c(H+)+c(Na+),所以c(Na+)-c(F-)=c(OH-)-c(H+)=10-6 mol/L-10-8 mol/L=9.9×10-7mol/L,故B正确.
C、PH=2的盐酸溶液中氢离子浓度是0.01mol/L,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,氯化氢和氢氧化钡都是强电解质,所以氢离子和氢氧根离子恰好反应,溶液呈中性,溶液中c(H+)=c(OH-),故C正确.
D、向氨水中加入氯化铵后,铵根离子浓度增大能抑制氨水的电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以溶液中c(OH-)/c(NH3?H2O)减小,故D错误.
故选D.
本题解析:
本题难度:简单
4、简答题 (1)室温时,将0.1mol氨气溶于水制成1L溶液,则该溶液的pH为______[假设室温时,Kb(NH3?H2O)=1.0×10-5mol?L-1]
若在上述溶液中加入稀硫酸,使其恰好完全反应,所得溶液中离子浓度由大到小的顺序为______;若向所得溶液中加入少量硫酸铵固体,使溶液的浓度增大,水解程度______(填“增大”、“减小”或“不变”).
(2)T=593K,P=2×107Pa的体积百分比为60%的CO及40%的H2是混合物,让其通过活性氧化锌催化剂后,将有一部分转化为甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).已知CO的转化率为16%,则H2的转化率是______,若容器的容积不变,此时气体的压强是______Pa.
参考答案:(1)c(OH-)=
本题解析:
本题难度:一般
5、选择题 二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-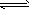 H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
[? ]
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C.Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-)
参考答案:AB
本题解析:
本题难度:一般