时间:2020-07-08 01:00:02
1、选择题 阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是?(?)
A.分子式为: C14H18N2O5,阿斯巴甜属于蛋白质
B.阿斯巴甜能与H2发生加成反应
C.阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D.阿斯巴甜在一定条件下能发生水解反应
参考答案:C
本题解析:
答案:无(原题有误)
A、正确,分子中有肽键;B、正确,苯环能与3个H2分子加成;C、正确,在强酸强碱中或在高温加热时易水解生成苦味的苯丙氨酸;D、正确。
本题难度:简单
2、选择题 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如右图所示。
关于咖啡鞣酸的下列说法正确的是
A.分子式为C16H20O9
B.可与FeCl3溶液发生显色反应,也可与浓溴水既能发生取代反应又能发生加成反应,且1mol物质最多消耗4 molBr2
C.1mol物质与足量的金属钠反应可消耗Na 6mol,完全水解时可消耗8molNaOH
D.与苯环直接相连的原 子都在同一平面上
子都在同一平面上
参考答案:BD
本题解析:略
本题难度:一般
3、选择题 某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59 g·L-1,其分子式为(?)
A.C2H6
B.C4H10
C.C5H8
D.C7H8
参考答案:B
本题解析:N(C)∶N(H)=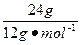 ∶
∶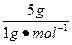 =2∶5,实验式为C2H5,M="2.5" g·L-1×22.4 L·mol-1="58" g·mol-1,故B选项符合题意。
=2∶5,实验式为C2H5,M="2.5" g·L-1×22.4 L·mol-1="58" g·mol-1,故B选项符合题意。
本题难度:一般
4、选择题 巴豆酸的结构简式为CH3-CH=CH-COOH.现有:1.氯化氢、2.溴水、3.纯碱溶液、4.乙醇、5.酸化的高锰酸钾溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A.只有2、4、5
B.只有1、3、4
C.只有1、2、3、4
D.1、2、3、4、5
参考答案:D
本题解析:略
本题难度:简单
5、填空题 (6分)按要求书写下列化学方程式:
(1)制取TNT炸药:?
(2)苯甲醛的银镜反应:?
(3)合成酚醛树脂:?
参考答案:(1)
(2)C6H5-CHO+2[Ag(NH3)2]OH ?C6H5-COONH4+2Ag↓+3NH3+H2O
?C6H5-COONH4+2Ag↓+3NH3+H2O
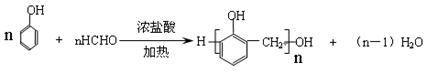
(3)
本题解析:(1)制取TNT炸药:
(2)苯甲醛的银镜反应:
C6H5-CHO+2[Ag(NH3)2]OH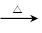 ?C6H5-COONH4+2Ag↓+3NH3+H2O
?C6H5-COONH4+2Ag↓+3NH3+H2O
(3)合成酚醛树脂:
本题难度:一般