时间:2020-07-08 00:56:33
1、选择题 为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
A.②④
B.①②⑤
C.③④⑤
D.②③
2、选择题 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+) = c(SO42-)
B.c(NH4+)=2c(SO42-)
C.2c(NH4+)=c(SO42-)
D.c(OH-)+c(SO42-) = c(H+)+c(NH4+)
3、选择题 已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COOH溶液,下列说法正确的是
A.CH3COONa溶液中,c(CH3COO-)> c(Na+) >c(OH-) >c(H+)
B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF
C.两溶液相比较,CH3COONa溶液中的离子总数多
D.CH3COONa溶液中,c(H+)+c(CH3COOH)=c(OH-)
4、选择题 下列说法错误的是
A.25℃时,pH=9的NaHA溶液中: c(A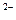 )< c(H2A)
)< c(H2A)
B.25℃时,pH=9的NaHA溶液中: c(H+)十c(H2A)= c(OH
c(OH
5、填空题 (14分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
请回答下列问题:
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)步骤⑤的操作为 。
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |