时间:2020-07-08 00:51:16
1、推断题 A、B、C、D均为4种常见的短周期元素,原子序数依次增大,A、C能组成分子式为A2C2和A2C两种常见的化合物,它们在常温下都 是液体;B与A既可形成分子X,也可形成阳离子Y,X、Y都是10电子的粒子;D 在同周期中原子半径最大。
(1)D元素在周期表中的位置是____;D的单质在C的单质中燃烧生成固体W的电子式为____; 液态X类似A2C,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为____。
(2)将C的单质通入1 mol/L KI和0.1 mol/L H2SO4混合溶液中,反应的离子方程式为____。
(3)M、N分别是由A、B、C、D四种元素中的其中三种元素组成的强电解质。M 的水溶液呈碱性,它能抑制水的电离;N的水溶液呈酸性,它能促进水的电离。则M、N分别为___、____(填化学式);若将0.1 mol/L的M 和0.2 mol/L的N两溶液等体积混合,所得溶液中离子浓度的大小顺序为____。
参考答案:(1)第三周期第IA族 ;Na2O2 ;2NH3 NH4++NH2-
NH4++NH2-
(2)4H++4I-+O2=2I2+2H2O
(3) NaOH ;NH4NO3 (或NH4NO2 )? ;c(NO3-) [或c(NO2-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
本题解析:
本题难度:一般
2、选择题 下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1mol?L-1Na2CO3溶液中:[OH-]=[HCO3]+[H+]>[C
参考答案:A、碳酸钠溶液中,根据物料守恒得:C(Na+)=2C(HCO3-)+2C(CO32-)+2C(H2CO3),溶液呈电中性,溶液中阴阳所带电荷相等,C(Na+)+C(H+)=C(HCO3-)+2C(CO32-)+C(OH-),由两个等式得C(OH-)=C(HCO3-)+2C(H2CO3),碳酸钠在水溶液里以电离为主,水解为次,所以C(CO32-)>C(OH-),故A错误.
B、硫酸铵化学式中,铵根离子和硫酸根离子的个数比=2:1,水溶液中铵根离子水解导致溶液中C(H+)>C(OH-),但水解是微弱的,所以C(NH4+>C(SO42-),故B错误.
C、碳酸氢根离子水解导致C(Na+)>C(HCO3-)、C(H+)<C(OH-),但碳酸氢根离子的水解是微弱的,所以C(HCO3-)>C(OH-),故C错误.
D、硫化钠化学式中钠离子和硫离子个数比是2:1,硫化钠溶液中根据物料守恒得C(Na+)=2C(HS-)+2C(S2-)+2C(H2S),故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 下列叙述中一定正确的是
[? ]
A.0.1mol/L的CH3COOH溶液中,由水电离的c(H+)为10-13?mol/L?
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1︰10?
C.仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.1.0?mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
参考答案:BD
本题解析:
本题难度:一般
4、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
[? ? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 下图为常温下用0.1000?mol/L?NaOH溶液滴定20.00?mL0.1000?mol/L盐酸和20.00?mL?0.1000?mol/L醋酸的曲线。若以HA表示酸,下列判断和说法正确的是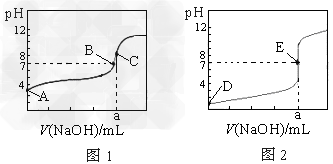
[? ]
A.图1是滴定盐酸的曲线
B.B、E状态时,两溶液中离子浓度均为c(Na+)?=?c(A-)
C.C、E状态时,反应消耗的酸n(CH3COOH)?=?n(HCl)?
D.当0?mL<V(NaOH)<20.?00?mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)?>c(Na+)>?c(H+)?>?c(OH-)
参考答案:BC
本题解析:
本题难度:一般