时间:2020-07-08 00:50:15
1、选择题 在相同温度时,100mL0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值中,前者大于后者的是
[? ]
参考答案:A
本题解析:
本题难度:一般
2、选择题 温度一定时,用水稀释0.1mol/L氨水时,溶液中随着加水量的增加而减小的是( )
A.c(OH-)
B.c(OH-)/c(NH3?H2O)
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量
参考答案:加水稀释,促进氨水电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,故A正确;
B.加水稀释,促进氨水电离,n(OH-)增大,n(NH3.H2O)减少,所以n(OH-)Vn(NH3.H2O)V增大,即C(OH-)C(NH3.H2O)增大,故B错误;
C、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故C错误;
D、由NH3.H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
A.a点导电能力比b点强
B.对于b、c两点,Kb>Kc
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.X的值接近7,但大于7
参考答案:D
本题解析:A、b点离子浓度大于a点,故导电能力强;
B、K只与温度有关,温度相同,K相同;
C、上线为氨水,下线为氢氧化钠,故等pH,氨水浓度大于氢氧化钠浓度,故c点消耗氢氧化钠体积大;
D、稀释过程中pH减小,无限接近7,但大于7,最后水的电离不能忽略。
本题难度:简单
4、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:醋酸和硫酸溶液中的水电离出的氢离子和氢氧根离子的浓度相等,水电离出的氢离子就等于溶液中的氢氧根离子,pH均为3时溶液中氢离子的溶度为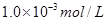 ,根据水的离子积可以得到
,根据水的离子积可以得到 ,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中
,A正确;加水稀释相同的倍数由于醋酸是弱酸稀释的过程中会电离出氢离子,而硫酸溶液中没有此过程,所以稀释相同的倍数时硫酸的PH变化较大,醋酸的PH变化较小,B错误;醋酸是一元酸,硫酸时二元酸当二者的PH相同时,溶液中 ,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
,C错误;由于醋酸中还有没有电离的醋酸分子所以当加入足量的锌片后醋酸产生的氢气比硫酸多,D错误;所以答案选A。
本题难度:简单
5、填空题 (5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
参考答案:(5分)(1)若a=7,则HA为强酸;若a>7,则HA为弱酸。 (2) 否
(3) 弱 (4) ①10-5-10-9 ②10-9
本题解析:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,答案为:a=7为强酸,a>7为弱酸;
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,答案为:否;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,答案为:弱;
(4)①一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9; ②
依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9,答案为:10-5-10-9;10-9.
考点:考查弱电解质的电离,酸碱混合,PH值等知识。
本题难度:困难