时间:2020-07-08 00:45:22
1、填空题 (三选一)【物质结构与性质】
已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。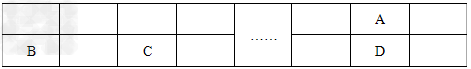
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是__________;D的电子排布式为:____________。
(2)A和D的氢化物中,沸点较高的是_______,原因是__________________;A和B的离子中,半径较小的是__________(填离子符号)。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是_______________。 
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
参考答案:(1)第三,ⅢA;1s22s22p63s23p5?
(2)A;A的氢化物分子间可以形成氢键,而D的氢化物不能;Na+
(3) ?
?
(4)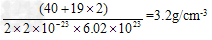
本题解析:
本题难度:一般
2、选择题 下列关于非金属元素气态氢化物的叙述正确的是( )
A.气态氢化物的水溶液都是酸
B.气态氢化物都可由非金属单质和H2直接化合
C.气态氢化物是极性分子
D.气态氢化物都是共价化合物
参考答案:A、非金属元素氮元素的气态氢化物是氨气,它的水溶液氨水显碱性,属于碱,故A错误;
B、不是所有的非金属都能直接与氢气化合,如碲、砹等非金属不能直接与氢气化合,故B错误;
C、非金属元素气态氢化物有的是极性分子,如水分子,有的是非极性分子,如甲烷分子等,故C错误;
D、非金属元素气态氢化物中,只含有共价键,均是共价化合物,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
[? ]
A.X的氢化物溶于水显酸性?
B.Y的氧化物是共价化合物
C.其离子半径大小:?Z>Y>X?
D.X和Z的最高价氧化物对应的水化物都是强酸
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列事实或因果关系正确的是?
A.SO2的水溶液能导电说明SO2是电解质
B.HClO是弱酸,所以NaClO是弱电解质
C.某无色溶液加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则该溶液含有NH4+
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定存在大量CO32-
参考答案:C
本题解析:SO2是非电解质,其水溶液导电,是生成的亚硫酸电离出的离子形成的;次氯酸钠是强电解质,B不正确;D不正确,也可能是碳酸氢盐或亚硫酸盐或亚硫酸氢盐,答案选C。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养。有利于培养学生严谨的逻辑思维能力,提高学生的应试能力。
本题难度:一般
5、选择题 短周期元素x和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n的关系不可能是?
[? ]
A.m-13=n
B.n+5 =m
C.m+8=n
D.n-ll=m
参考答案:C
本题解析:
本题难度:简单