时间:2020-07-08 00:40:54
1、实验题 高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾: 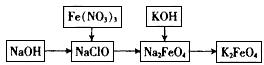
(1)①在次氯酸钠溶液中加入固体烧碱形成碱性环境。
①将研磨后的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。该反应的离子方程式为_______________________。
②将KOH加入到反应后的溶液中搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为______________________;推测该反应发生的理由是______________________。
④依次用甲苯、乙醇、乙醚洗涤以除去水分和KNO3、KCl、KOH等杂质。
(2)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价格)。现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液和稍过量的KCrO2,充分反应后,转移到250mL容量瓶中,定容。量取25.00mL溶液,用稀硫酸酸化后,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,共用去标准溶液33.33mL。
①用离子方程式表示标准溶液显酸性的原因:____________________。
②用离子方程式表示上述滴定反应原理:______________________;如果滴定过程中,剧烈振荡,会使部分亚铁离子被空气中的氧气氧化,导致实验结果偏低。写出亚铁离子在酸性条件下被空气中氧气氧化的离子方程式:______________________。
③上述实验制得的样品中高铁酸钾的质量分数为____________________。
2、简答题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 饱和H2S溶液 3.9 SnS沉淀完全 1.6 FeS开始沉淀 3.0 FeS沉淀完全 5.5 |
3、实验题 硬铝废料(含90%铝、2.5%镁和7.5%铜)可制取明矾 KAl(SO4)2·12H2O,某探究小组设计了下列实验。? 
请回答以下问题:
(1)写出步骤②的离子方程式___________;简述用pH试纸测定溶液 pH的过程:_____________。
(2)步骤④包括三个操作环节,分别是___________、_____________、_____________。
(3)步骤⑤不直接用水洗的原因是_________________,洗涤的操作是___________。
(4)有人建议:直接将硬铝溶于稀H2SO4中,过滤:滤液中加适量K2SO4得到溶液丙,再进行后续实验。请你评价此建议的可行性_____________。
4、实验题 “酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。 
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式______________________
(2)饱和碳酸钠溶液的主要作用是____________、____________、____________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是______________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是____________________。
5、实验题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置和实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,又有晶体析出,…… 
请回答下列问题:
(1)装置的连接顺序是:(a)接(_____)→(_____)接(____);(b)接(____)
(2)A中常选用的固体反应物为_________;D中应选用的液体为_____________;
(3)B装置中分液漏斗内所加试剂为_________;第二步中必须先让________装置先发生反应。C中用球形干燥管而不用直导管,其作用是__________;
(4)第四步分离所得的晶体中含有多种成分,试证明其中含有NH4Cl,简要写出操作过程和现象________________________。