时间:2020-07-08 00:36:32
1、填空题 在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是______________,同时生成微量的_________________。
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程_______________________,_________________________。
(3)若已知反应Be2C+4H2O==2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________________。
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是 ________________________________________________________________________。 用电子式表示BeCl2的形成过程:________________________________________。
参考答案:(1)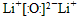 ;Li3N
;Li3N
(2)Be(OH)2;Be(OH)2+2H+==Be2++2H2O;Be(OH)2+2OH-==BeO22-+2H2O
(3)Al4C3+4OH-+4H2O==4AlO2-+3CH4↑
(4)将BeCl2加热到熔融状态不能导电证明BeCl2是共价化合物;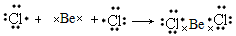 ?
?
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E五种前四周期元素,原子序数依次增大。已知D元素原子核外的M层上有3个单电子存在。在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置。回答下列问题:
(1)元素E的元素符号为________,最高正价为_________,最外层电子构型为_____________;
(2)C的常见氯化物中,C元素的杂化类型为_____________,A元素在其含氧酸根离子中的杂化类型为
__________,A、C两元素所形成化合物的晶体类型是____________;
(3)D的氢化物的立体结构呈________型,该氢化物比元素B的氢化物沸点低的原因是____________。
(4)元素B的离子(B3-)与某金属离子(X+)形成化合物的晶胞结构如图所示。则晶胞中顶点上的小球应代表________(填“B3-”或“X+”)。 
参考答案:(1)As;+5;4s24p3?
(2)sp3;sp2;原子晶体
(3)三角锥;B元素的氢化物之间存在有氢键?
(4)B3-
本题解析:
本题难度:一般
3、选择题 aX和bY分别是元素X和元素Y的一种同位素,已知a>b,元素X和元素Y的式量的关系是
A.大于
B.等于
C.小于
D.不能确定
参考答案:D
本题解析:元素的式量="A·a%" + B·b% + C·c%+…
元素的式量由元素的各种同位素的式量及其原子所占的原子个数百分数(丰度)决定,同位素的原子量较大,元素的原子量不一定较大。如A大,但它所属的元素的式量不一定就大,还与B、C及b%、c%、…的大小有关,这是一个数学计算问题。
该题容易错选A,主要错因是没有分清元素的平均原子量和原子的原子量的概念。
本题难度:简单
4、填空题 有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L。D的M层上有7个电子。
(1)A、B、C、D各是什么元素?A__________B__________C__________D__________
(2)写出B、C、D最高价氧化物的水化物化学式,并比较其酸碱性。__________,__________,
__________,_____________________
(3)比较D的气态氢化物与H2S和HF的稳定性__________,理由是______________________________。
参考答案:(1)A:O;B:Na;C:Mg;D:Cl
(2)NaOH;Mg(OH)2;HClO4;酸性由强到弱:HClO4、Mg(OH)2、NaOH(或碱性由强到弱:NaOH 、Mg(OH)2、HClO4)
(3)HF>HCl>H2S;元素非金属性由强到弱是F>Cl>S
本题解析:
本题难度:一般
5、选择题 若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第二层电子数不超过15个,而且各电子层容纳电子数最多为2n2个,则元素周期表中第3、4、5周期含有的元素分别有
[? ]
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种
参考答案:C
本题解析:
本题难度:一般