时间:2020-07-08 00:31:51
1、选择题 实验室中需要0.2 mol·L-1的NaOH溶液65 mL,配制该溶液时应选用的容量瓶的规格和称取的NaOH质量分别是( )。
A.65 mL,0.52 g
B.70 mL,0.56 g
C.100 mL,0.52 g
D.100 mL,0.8 g
参考答案:D
本题解析:实验室中需要0.2 mol·L-1的NaOH溶液65 mL,应选用100 mL的容量瓶,称取的NaOH质量为0.2 mol·L-1×0.1 L×40 g/mol=0.8 g。
本题难度:简单
2、选择题 将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应。则X为( )
A.ClO2 B.Cl2O C.Cl2 D.Cl2O3
参考答案:A
本题解析:因NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液加热时发生氧化还原反应,Cl元素的化合价降低,S元素的化合价升高,Na2SO3作还原剂,S元素的化合价由+4价升高为+6价,设X中Cl元素的化合价为x,由电子守恒可知,2×(5-x)=1×(6-4),解得x=+4,
A、ClO2中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+4价,故A正确;B、Cl2O中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+1价,故B错误;C、Cl2中,Cl元素的化合价为0,故C错误;D、Cl2O3中,O为-2价,由化合物中正负化合价的代数和为0,则Cl为+3价,故D错误。
考点:本题考查氧化还原反应中电子守恒的应用。
本题难度:一般
3、选择题 在100mL 0.2mol/LHBr和0.1mol/L的H2SO3的溶液里通入0.01mol Cl2,反应后溶液的体积没有变化,下列说法正确的是( )
A.反应的溶液中H2SO3浓度仍为0.1mol/L
B.反应的溶液中HBr浓度仍为0.2mol/L
C.反应的溶液中Cl-浓度为0.1mol/L
D.反应溶液中H+浓度没有变化
参考答案:A、首先反应Cl2+H2SO3=H2SO4+2HCl,原溶液中n(H2SO3)=0.1mol×0.1mol/L=0.01mol,
由方程式可知,0.01mol Cl2与0.01molH2SO3恰好完全反应,反应后的溶液中不会H2SO3,故A错误;
B、Cl2与H2SO3恰好反应,HBr没有参加反应,HBr浓度不变,反应后的溶液中HBr浓度仍为0.2mol/L,故B正确;
C、0.01mol Cl2完全反应,溶液中n(Cl-)=2n( Cl2)=0.01mol×2=0.02mol,反应后的溶液中Cl-浓度为0.02mol0.1L=mol/L
,故C错误;
D、溶液中HBr浓度不变,生成H2SO4的浓度等于H2SO3浓度,但H2SO4是强电解质,完全电离,反应后溶液中H+浓度增大,故D错误.
故选:D.
本题解析:
本题难度:一般
4、选择题 a mol FeS与b mol FeO投入到V L、c mol·L 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④ mol
mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:FeS和FeO在反应中共失去电子的物质的量是(a+8a+b)mol,所以被还原硝酸的物质的量是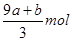 ,则没有被还原的硝酸的物质的量是
,则没有被还原的硝酸的物质的量是 mol;根据铁原子守恒可知,没有被还原的硝酸是(3a+3b)mol,其质量是(a+b)×189 g,答案选D。
mol;根据铁原子守恒可知,没有被还原的硝酸是(3a+3b)mol,其质量是(a+b)×189 g,答案选D。
考点:考查氧化还原反应中的计算
点评:该题是高考中的常见题型,属于中等难度的是,试题基础性强,侧重学生能力的考查。化学计算中的守恒法主要是指质量守恒定律、电子的得失守恒、原子守恒和电荷守恒等,需要学生在平时的训练中注意总结和积累。
本题难度:一般
5、简答题 在含有35.8g?Na2CO3和NaHCO3混合物的溶液中加入200mL?某浓度的盐酸,恰好完全反应,生成8.96L?CO2(标准状况).问:
(1)原溶液中有______mol?Na2CO3,______mol?NaHCO3.
(2)盐酸的物质的量浓度.
参考答案:(1)标准状况下CO2的物质的量为8.96L22.4L/mol=0.4mol,
设Na2CO3和NaHCO3的物质的量分别为x、y,
由质量即碳原子守恒可知,
本题解析:
本题难度:一般