时间:2020-07-08 00:29:42
1、选择题 .已知C6H5ONa+CO2+H2O―→C6H5OH+NaHCO3,某有机物的结构简式如下: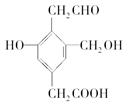
Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO 3的物质的量之比为
A.3∶3∶2
B.3∶2∶1
C.1∶1∶1
D.3∶2∶2
2、填空题 (6分)在200ml 0.5 mol·L-1的Al2(SO4)3溶液中,Al3+的物质的量浓度是?,Al3+的质量是?,SO42-的个数是?。
3、选择题 将含1mol HCl的稀盐酸,逐滴加入含0.2 mol NaOH和0.5 molNa2CO3的混合溶液中,充分反应后溶液中各物质的量是
| | HCl/mol | NaCl/mol | NaOH/mol | Na2CO3/mol | NaHCO3/mol |
| A | 0 | 1 | 0.1 | 0 | 0.1 |
| B | 0 | 1 | 0 | 0.1 | 0.1 |
| C | 0.2 | 0.8 | 0 | 0 | 0.2 |
| D | 0 | 1 | 0 | 0 | 0.2 |
4、选择题 NA为阿伏加德罗常数,下列说法中正确的是(? )
A.17 g 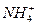 中含有的电子数为10NA
中含有的电子数为10NA
B.1 mol·L-1 Mg(NO3)2溶液中含有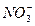 的数目为2NA
的数目为2NA
C.标准状况下,22.4 L甲苯所含的分子数为NA
D.室温下,28.0 g乙烯和丙烯中混合气体中含有的碳原子数为2NA
5、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法中正确的是
A.1 mol Cl2与足量NaOH反应,转移的电子数为2nA
B.1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA
C.常温常压下,22.4LSO2气体中含有的原子数小于3nA
D.0.1 mol/LNaOH溶液中含有Na+的数目为0. 1 nA