时间:2020-07-08 00:26:08
1、选择题 在标况下,将V L A气体(摩尔质量M g/mol)溶于1L水中,所得A的水溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为 ( )
A.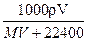
B.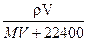
C.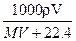
D.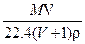
2、计算题 下图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上的所列内容后填写
| ?葡萄糖注射液 Glucose Injection 规格:250 mL内含葡萄糖12.5 g 生产批号:0203203? 2 有效期:至2004年3月 配伍:5% 姓名:?床号:? |
3、选择题 设NA为阿伏伽德罗常数。下列叙述正确的是
A.1mol甲醇中含有C-H键的数目为4NA
B.标准状况下,2.24L已烷含有分子的数目为0.1NA
C.12克金刚石中含有的共价键数目为2NA
D.1 mol 甲基所含的电子数为10NA
4、选择题 设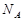 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.23g钠与足量氧气充分反应,转移的电子个数为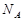
B.将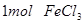 水解制成胶体,所得胶体的微粒数为
水解制成胶体,所得胶体的微粒数为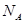
C.1mol Na2O2与水完全反应时转移电子数为2NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
5、选择题 下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是(?)
A.100 ml 0.5 mol/L MgCl2溶液
B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液
D.200 ml 0.25 mol/L CaCl2溶液