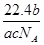时间:2020-07-08 00:23:20
1、填空题 (4分)下图表示氯化钠溶于水后形成氯化钠溶液的示意图。
图中框内NaCl溶液中NaCl与水分子的物质的量之比为 ,
氯化钠溶液的质量分数为 。
2、选择题 下列说法正确的是(?)
①2mol铁原子?②1mol Fe3+?③0.5mol 氧?④氨的摩尔质量是17g
⑤1L 0.1mol/L NH4NO3溶液中氮原子的物质的量为0.2 mol?⑥0.5mol 氮气
A.①②④⑥
B.①②⑤⑥
C.①②③⑥
D.都正确
3、选择题 V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol·L-1的盐酸混合均匀
4、选择题 关于a g 氢气 和b g氦气,下列说法正确的是? (? )
A.同温、同压下,氢气 和氦气的体积比为a:2b
B.同温、同压下,若a=b,则氢气 和氦气的物质的量之比为2:1
C.体积相同时,氦气的质量一定大于氢气的质量
D.同温同压下,若二者的物质的量相同,其所含原子数也相同
5、选择题 NA表示阿伏加德罗常数,如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是( )
A.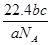 L
L
B.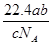
C.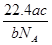 L
L
D.