时间:2020-07-08 00:20:30
1、选择题 质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为
[? ]
A.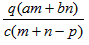
B.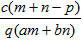
C.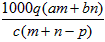
D.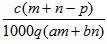
2、实验题 (9分)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL:
(1)配制时,必须使用到的玻璃仪器有 、 、 、
(2) 使用容量瓶前必须进行的一步操作是_____________________
(3) 要完成本实验该同学应称出NaOH______g
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是__________
①称量固体药品时所用的砝码是生锈的
②称量时间过长
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度
3、填空题 根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有n个OH-,则可求出此溶液中______________为________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中________________为____________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中______________为___________。
4、选择题 同温同压下,等质量的下列气体所占有的体积最大的是
A.O2
B.CH4
C.CO2
D.SO2
5、选择题 下列叙述中,正确的是
[? ]
A.相同质量的CO和N2,其体积比为1:1
B.等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等
C.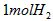 和
和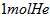 中,所含的分子数相同、原子数相同、质量也相同
中,所含的分子数相同、原子数相同、质量也相同
D.体积为22.4L的O2,其质量可能为32g