时间:2020-07-08 00:10:59
1、填空题 (9分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用离子方程式表示) 。
(2)下图是 0.1mol·L-1电解质溶液的pH 随温度变化的图像。
其中符合0.1mol·L-1NH4Al(SO4)2的 pH随温度变化的曲线是 (填写序号),导致 pH 随温度变化的原因是 ;
(3)室温时,向100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
①试分析图中 a、b、c、d 四个点,水的电离程度最大是 点;在 a 点,反应的离子方程式为 。
②下列对 b点时的说法正确的是 。
A.Al3+已经完全沉淀
B.c(Na+)>c(SO42-)>c(NH4+)
C.Al(OH)3部分溶解
D.消耗的 NaOH 溶液体积大于300mL
参考答案:(1)Al3+ +3H2O  Al(OH)3 +3H+(2)Ⅰ 、 NH4Al(SO4)2溶液水解显酸性,升高温度,水解程度增大。溶液酸性增强。(3)① a Al3+ + 3OH—=Al(OH)3↓ ②ABD
Al(OH)3 +3H+(2)Ⅰ 、 NH4Al(SO4)2溶液水解显酸性,升高温度,水解程度增大。溶液酸性增强。(3)① a Al3+ + 3OH—=Al(OH)3↓ ②ABD
本题解析:(1)NH4Al(SO4)2可作净水剂是因为溶于水时产生的Al3+发生水解生成有吸附性的Al(OH)3,能吸附水中的悬浮物,离子方程式为:Al3+ + 3H2O  Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
考点:盐类水解、化学图像的分析、
本题难度:困难
2、选择题 下列表述正确的是
A.将 0.1 mol·L-1HCl溶液加热到100℃,溶液的pH仍为1
B.将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低
C.常温下,若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12
D.在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性
参考答案:C
本题解析:A.盐酸易挥发,将 0.1 mol·L-1HCl溶液加热到100℃,盐酸因挥发c(H+)降低,溶液的pH减小,A项错误;B.将pH=4的醋酸溶液加水稀释后,酸性减弱,c(H+)降低,由于c(H+)·c(OH-)=KwW的乘积不变,溶液中c(OH-)升高,B项错误;C.常温下,若1mLpH=1的盐酸n(H+)=0.0001mol,与10mLNaOH溶液混合后溶液的pH=7,说明酸碱恰好反应,NaOH的物质的量为0.0001mol,则c(NaOH)=0.01mol/L,NaOH溶液的pH=12,C项正确;D.酚酞的变色范围是8-10,PH小于8,呈现无色,在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液可能显中性,D项错误;选C。
考点:考查影响电解质溶液的因素,PH的计算,溶液酸碱性的判断。
本题难度:一般
3、填空题 (14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
参考答案:(1)Na>S>O(1分) (2)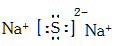 (1分) (3) H2O H2S(各1分)
(1分) (3) H2O H2S(各1分)
(4) H2O2+SO2=H2SO4(2分)
(5)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分,不写稀扣1分)
(6)NH4++HSO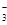 +2OH- △NH3↑+SO32—+ 2H2O(2分,不写加热扣1分)
+2OH- △NH3↑+SO32—+ 2H2O(2分,不写加热扣1分)
(5) c(HC2O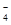 )>c(H+)>c(C2O
)>c(H+)>c(C2O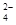 )(2分)反应生成的MnSO4能催化该反应,加快反应速率。(2分)
)(2分)反应生成的MnSO4能催化该反应,加快反应速率。(2分)
本题解析:X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,W是地壳中含量最多的元素,因此W是O。W与Q同主族,因此Q是S。X是原子半径最小的元素,则X是H。X与M同主族,且M的原子序数大于氧元素,则M是Na。常温下,六种元素的常见单质中三种为气体,三种为固体,且X能与Y、Z、W分别形成电子数相等的三种分子,所以Y是C,Z是N。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则W、M、Q四种元素的原子半径由大到小的排列顺序是Na>S>O。
(2)元素M和Q可以形成化合物Na2S,含有离子键的离子化合物,电子式为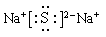 。
。
(3)非金属性越强,氢化物的稳定性越强,Z、W、Q三种元素的非金属性强弱顺序为O>N>S,则简单气态氢化物中稳定性最强的是H2O。由于水分子间以及氨气分子间均存在氢键,所以沸点最低的是H2S。
(4) W的一种氢化物含18个电子, 则该氢化物是双氧水。双氧水与SO2化合的化学方程式为H2O2+SO2=H2SO4。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,因此是稀硝酸,则该反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,则A应该是亚硫酸氢铵,因此A与足量氢氧化钠溶液在加热条件下反应的离子方程式为NH4++HSO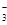 +2OH- △NH3↑+SO32—+ 2H2O。
+2OH- △NH3↑+SO32—+ 2H2O。
(7)分子式为X2Y2W4的化合物是乙二酸,与含等物质的量的KOH的溶液反应后得到草酸氢钾,所得溶液呈酸性,说明草酸氢根的电离程度大于其水解程度,所以该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O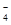 )>c(H+)>c(C2O
)>c(H+)>c(C2O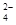 )>c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。因此根据外界条件对反应速率的影响分析,此时影响因素应该考虑催化剂,即由于反应生成的MnSO4能催化该反应,从而加快反应速率。
)>c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。因此根据外界条件对反应速率的影响分析,此时影响因素应该考虑催化剂,即由于反应生成的MnSO4能催化该反应,从而加快反应速率。
考点:考查元素推断、元素周期律的应用;氧化还原反应、溶液中离子浓度大小比较以及外界条件对反应速率的影响等
本题难度:困难
4、填空题 酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
参考答案:(1)抑制Sn2+水解, 防止Sn2+被氧化 (2)SnCl2 + Na2CO3 =" SnO" + CO2↑+2NaCl(3)取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净(3分)(4)小于1 (2分。若写成≤1给1分) (5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O (6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
本题解析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-
本题难度:困难
5、填空题 (每小题4分,共12分)
(1)氨水和稀盐酸反应后的溶液呈中性,反应后所得溶液中的离子浓度大小关系是__ _。
(2)Na2CO3溶液中,其离子浓度从大到小关系为 。
(3)有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.则原混合溶液中Ba(OH)2的物质的量浓度 。
参考答案:(1)c(NH4+)=c(Cl-) >c(OH-)=c(H+) ;(2) C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+);
(3)0.025mol/L
本题解析:(1)氨水和稀盐酸溶液呈中性,c(OH-)=c(H+) 溶液中含有铵根离子、氯离子、氢氧根离子和氢离子,故离子浓度为c(NH4+)=c(Cl-) >c(OH-)=c(H+);(2)碳酸钠为强碱弱酸盐,水解呈碱性,以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);(3)发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O、2NaOH+H2SO4=Na2SO4+2H2O,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半,说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的,所以Ba(OH)2、NaOH的物质的量浓度比为1:2,因为pH=13,所以原溶液中2c[Ba(OH)2]+c(NaOH)=0.1mol/L,故2c[Ba(OH)2]+2c[Ba(OH)2]=0.1mol/L,解得c[Ba(OH)2]=0.025mol/L,答案为0.025mol/L
考点:化学方程式的有关计算
本题难度:一般