时间:2020-07-08 00:10:39
1、选择题 amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.a/4bmol-1
B.b/4a mol-1
C.a/b mol-1
D.b/a mol-1
2、选择题 把含硫酸铵和硝酸铵的混合液a L分成两等份。一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为
A.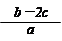
B.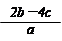
C.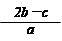
D.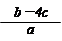
3、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是 (? )
A.33.6升CO2与O2的混合气中,含有的氧原子数为3 NA
B.15克甲基正离子(CH3+)含有的电子数为8NA
C.1molCl2与任何物质充分作用,转移电子数都为2NA
D.将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子
4、填空题 现需配制0.2mol/LNaHCO3?溶液450mL,某同学如图转移溶液.
①图中的错误是______
②实验中应选择容量瓶的规格是______(选填100mL或500mL);实验时需称取NaHCO3的质量为______g
③配制时,其正确的操作顺序是______(字母表示,每个字母用且只能用一次).
A、每次用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B、准确称取计算量的固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C将溶解后的溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F、继续往容易瓶内小心加水,直接液面接近刻度2~3cm处.
5、选择题 NA为阿佛加德罗常数,下列叙述正确的是
A.22.4LO3 气体含有O3分子数为NA
B.常温常压下,4.6 g NO2气体含有的原子总数为0.3 NA
C.1L 0.5 mol/L CuCl2溶液中含有Cu2+数为0.5 NA
D.标准状况下,33.6 L H2O含有H2O分子数为1.5 NA