时间:2020-07-08 00:10:18
1、选择题 能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5?
A.①③④
B.①②
C.②④
D.②
参考答案:C
本题解析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在, 就证明了弱电解质。所以可以从以下方面判断醋酸是否是弱电解质:电离平衡方面、水解方面、离子浓度方面,据此判断正误。
①用浓硫酸和醋酸钠固体共热可以制得醋酸,利用的是醋酸的挥发性,所以不能证明醋酸是弱酸,故错误;②醋酸钠水溶液呈碱性,说明醋酸钠是强碱弱酸盐,所以能说明醋酸是弱酸,故正确;③醋酸能和碳酸钙反应放出CO2,说明醋酸酸性比碳酸强,但不能说明醋酸的电离程度,所以不能证明醋酸是弱酸,故错误;④pH=2的醋酸溶液稀释1000倍后的pH<5,说明醋酸存在电离平衡,稀释促进电离,能证明醋酸是弱酸,故正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和逆向思维能力。该题的关键是明确弱电解质的电离平衡特点,答题时注意从以下方面判断电解质是否是弱电解质:电离平衡方面、水解方面、离子浓度方面。
本题难度:简单
2、选择题 常温下,在pH=2的硫酸溶液中,水电离出来的H+的物质的量浓度为(? )
A.10-2 mol/L
B.10-12 mol/L
C.2×10-12 mol/L
D.0.02mol/L
参考答案:B
本题解析:根据水的电离方程式可知,酸或碱是抑制水的电离。pH=2的硫酸溶液中,氢离子浓度是0.01mol/L的,所以OH-的浓度是10-12mol/L.溶液中的OH-全部由水电离出来,所以水电离出来的H+的物质的量浓度也是10-12mol/L.答案选B。
本题难度:一般
3、选择题 己知:HCN(aq)与NaOH(aq)反应的△H="-12.1" kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol。则HCN在水溶液中电离的△H等于( )
A.-67.7 kJ/mol
B.-43.5 kJ/mol
C.+43.5 kJ/mol
D.+67.7 kJ/mol
参考答案:C
本题解析:根据能量守恒定律可知,HCN在水溶液中电离的△H=-12.1 kJ/mol+55.6kJ/mol=+43.5 kJ/mol,答案选C。
本题难度:一般
4、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:(?)
A.c(NH4+)>c(Cl–)>c(H+)>c(OH–)
B.c(Cl–)>c(NH4+)>c(H+)>c(OH–)
C.c(NH4+)>c(Cl–)>c(OH–)>c(H+)
D.c(Cl–)>c(NH4+)>c(OH–)>c(H+)
参考答案:C
本题解析:氨水为弱电解质,所以pH=11的氨水中一水合氨的物质的量远远大于pH=3的盐酸中HCl的物质的量,所以将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液呈碱性,根据电荷守恒可以得到,c(Cl–)+c(OH–)=c(H+)+c(NH4+),因为溶液呈碱性,所以c(OH–)>c(H+),即要使c(Cl–)+c(OH–)=c(H+)+c(NH4+)成立,必须有c(NH4+)>c(Cl–),所以溶液中离子浓度关系为c(NH4+)>c(Cl–)>c(OH–)>c(H+),所以本题选择C。
点评:本题考查了强弱电解质,电荷守恒、离子浓度的比较,这些知识点是高考考查的重点和难点,本题难度不大。
本题难度:一般
5、实验题 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: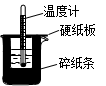
(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。?
(2)烧杯间填满碎纸条的作用是_________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量__________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是__________________________________。
(4)用50mL0.50mol/L的醋酸代替盐酸溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________。(填“偏大”、“偏小”或“无影响”)。
(5)完整地做一次这样的实验,需测定______次温度。
(6)大烧杯上如不盖硬纸板,求得的中和热数值?(填“偏大”、“偏小”或“无影响”)
参考答案:(1)环形玻璃搅拌棒?(2)减少实验过程中热量损失?
(3)不相等?相等?因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关?⑷偏小(5)3?(6)偏小
本题解析:考查中和热的测定及误差分析等
(1)在实验过程中,微粒使溶液混合均匀,需要搅拌,因此好缺少的仪器是环形玻璃搅拌棒。
(2)在实验过程中,需要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是减少实验过程中热量损失。
(3)由于中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关。所以改变酸或碱的用量,反应中放出的热量可以改变,但中和热是不变的。
(4)醋酸是弱电解质,存在电离平衡。而电离是吸热的,所以测定的数值会偏小。
(5)为了减小实验误差,应该至少测定3次温度,然后求其平均值。
(6)大烧杯上如不盖硬纸板,则热量会损失,因此得的中和热数值偏小。
本题难度:一般