时间:2020-07-08 00:09:37
1、选择题 共价键、离子键和范德华力都是微粒之间的不同作用力,下列物质的晶体中含有上述两种作用力的是(?)
①Na2O2? ②SiO2?③石墨? ④金刚石? ⑤CaCl2? ⑥白磷
A.①③⑥
B.①②④
C.②④⑥
D.③④⑤
参考答案:A
本题解析:①中含有离子键和非极性键,②中含有极性键,③中含有非极性键和分子间作用力,④中含有非极性键,⑤中含有离子键,⑥中含有非极性键和分子间作用力。所以正确的答案是A。
本题难度:简单
2、填空题 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示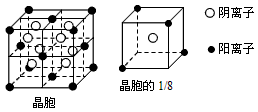
(1)A和E所形成的化合物的电子式是______________
(2)A、B、C、D四种元素的原子半径由小到大的顺序为_____________(用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是__________________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有______个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为
___________(结果保留一位小数)
参考答案:(1) ?
?
(2)F < Cl < Al < Na
(3)由于HF分子间存在氢键
(4)12
(5)3.2g/cm3
本题解析:
本题难度:一般
3、填空题 下图为一个金属铜的晶胞,请完成以下各题。
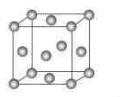
1)该晶胞“实际”拥有的铜原子数是?个。
2)该晶胞称为?。
A.六方晶胞? B.体心立方晶胞? C.面心立方晶胞
3)此晶胞立方体的边长为a cm,Cu的相对原子质量为64。阿伏加德罗常数为NA 。金属铜的晶体密度ρ为?g/cm3。(用a、NA?表示)。
4)铜原子采取的这种堆积方式的空间利用率为?。(填数值)
参考答案:(4分)
1) 4。2)C。3)256/(a3×NA)。4)74%。
本题解析:1)顶点的被8个晶胞共用,面心的被2个晶胞共用,故该晶胞“实际”拥有的铜原子数是8*(1/8)+6*(1/2)=4个。
2)该晶胞面心中有金属铜,故选C。
3)D原子半径为r,令晶胞的棱长为x,则2x2=(4r)2,所以x= 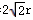 r,所以晶胞的体积V=
r,所以晶胞的体积V= 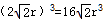 .晶胞中含有的铜原子数目为8×(1/8) +6×(1/2)=4,所以晶胞的质量为4×Mr/ NAg,所以晶体的密度为
.晶胞中含有的铜原子数目为8×(1/8) +6×(1/2)=4,所以晶胞的质量为4×Mr/ NAg,所以晶体的密度为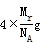 =256/(a3×NA)。
=256/(a3×NA)。
4)晶体铜晶胞是面心立方晶胞,故铜原子采取的这种堆积方式的空间利用率为74%。
点评:本题考查的是晶胞的计算的相关知识,题目难度中,考查学生分析问题、解决问题及计算的能力。
本题难度:一般
4、简答题 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
(1)镓的基态原子的电子排布式是______.
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为______,与同一个镓原子相连的砷原子成的空间构型为______.
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是______.?(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得.(CH3)3Ga中镓原子的杂化方式为______.
(5)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”).
(6)下列说法正确的是______(填字母).
A.砷化镓晶胞结构与NaCl相同B.GaP与GaAs互为等电子体
C.电负性:As>Ga?D.砷化镓晶体中含有配位键.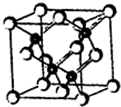
参考答案:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为[Ar]3d104s24p1,故答案为:[Ar]3d104s24p1;
(2)根据“均摊法”:白色球个数为6×12+8×18=4.由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故答案为:4;正四面体;
(3)由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,故答案为:NH3>AsH3>PH3;
(4)由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为:sp2;
(5)As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,故答案为:>;
(6)A.NaCl晶体中,钠离子位于顶点和面心,氯离子位于棱和体心,二者晶体结构不同,故A错误;
B.P和As位于同一主族,价电子数目相等,故B正确;
C.同周期元素从左到右元素的电负性逐渐增强,故C正确;
D.由于Ga原子最外层只有3个电子,而每个Ga原子与4个As原子成键,因此其中一个共价键必为配位键,故D正确.
故答案为:BCD.
本题解析:
本题难度:一般
5、判断题 AX4四面体 (A为中心原子,如硅、锗;X为配位原子,如氧、硫) 在无机化合物中很常见。四面体T1按下图所示方式相连可形成一系列“超四面体”(T2、T3···):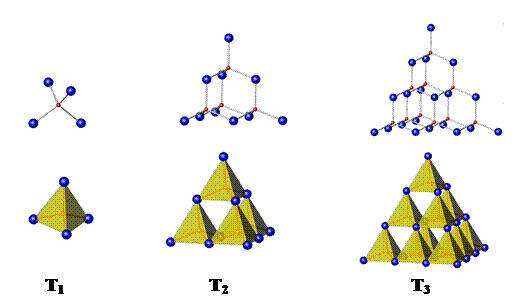
⑴ 上图中T1、T2和T3的化学式分别为AX4、A4X10和A10X20,推出超四面体T4的化学式。
⑵ 分别指出超四面体T3、T4中各有几种环境不同的X原子,每种X原子各连接几个A原子?在上述两种超四面体中每种X原子的数目各是多少?
⑶ 若分别以T1、T2、T3、T4为结构单元共顶点相连(顶点X原子只连接两个A原子),形成无限三维结构,分别写出所得三维骨架的化学式。
⑷ 欲使上述T3超四面体连接所得三维骨架的化学式所带电荷分别为+4、0和-4,A选Zn2+、In3+或Ge4+,X取S2-,给出带三种不同电荷的骨架的化学式(各给出一种,结构单元中的离子数成简单整数比)。
参考答案:⑴T4超四面体的化学式为A20X35
⑵T3超四面体中,有3种不同环境的X原子。
其中4个X原子在顶点上,所连接A原子数为1;
12个X原子在超四面体的边上,所连接A原子数为2;
4个原子在超四面体的面上,所连接A原子数为3。
T4超四面体中有5种不同环境的X原子。?
其中4个X原子在顶点上,所连接A原子数为1;
12个X原子在超四面体的边上但不在边的中心,所连接A原子数为2;
6个X原子在超四面体的边的中心,所连接A原子数为2;?
12个原子在超四面体的面上,所连接A原子数为3;?
1个在超四面体的中心,所连接A原子数为4。?
⑶化学式分别为 AX2,? A4X8,? A10X18,? A20X33。
答分别为? AX2,? AX2,? A5X9,? A20X33也可。
⑷A10X184+只能是Ge10S184+;
A10X18可以是Zn2Ge8S18,In2ZnGe7S18,In4Ge6S18;
A10X184-可以是
Zn4Ge6S184-, In8Ge2S184-, In6ZnGe3S184-, In4Zn2Ge4S184-, In2Zn3Ge5S184-;
本题解析:⑴根据连接规律,超四面体中A原子与上一个相邻的超四面体中X原子数相同,所以T4中,A原子数为20,X原子数为20+(10+5)=35,即T4为T20X35 。
⑵T3中,所有X原子都位于超四面体的面上,每个面如下图所示(顶点、交点位置为X原子):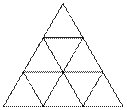
根据该图形的对称性可知:顶点X边接一个A,棱边X连接2个A,面心X连接3个A,共有3种环境不同的X。
T4中,面上X的位置如下图所示: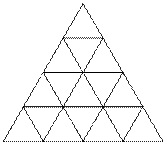
共有4种不同环境的X,分别连接1个,2个,2个,3个A原子,另外在该超四面体的内部还有一种环境的X,分别连接4个A。
⑶在如题所描述的结构中,顶点X原子被两个结构单元所共有,因此只有一半属于原四面体,其它位置的X原子,以及A原子仍属于该结构单元。所以
以T1为结构单元的结构中,化学式为:AX4/2,即AX2;
以T2为结构单元的结构中,化学式为:A4X6+4/2,即A4X8;
以T3为结构单元的结构中,化学式为:A10X16+4/2,即A10X18;
以T4为结构单元的结构中,化学式为:A20X31+4/2,即A20X33。
⑷根据结构组成,设“T3”的化学组成为:ZnxLnyGezSm
用尝试法,计算该组成所带的电荷数,可得一系列满足题意的答案。
本题难度:一般