时间:2020-07-08 00:06:08
1、填空题 (15分)[物质结构与性质]
I . 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答: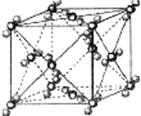
(1)干冰中一个分子周围有__________个紧邻分子。
(2)堆积方式与干冰晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)CO2中心原子的杂化方式为_______,有一种与CO2互为等电子体的离子,能用于鉴别Fe3+?,写出其电子式______________________。
II. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。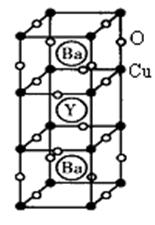
(4)写出Cu3+的电子排布式:?。
(5)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:?。
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为:_______________。
参考答案:(1)12? (2分)
(2)Cu? 74%?(各2分)
(3)SP? (1分)?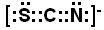 ?(2分)?
?(2分)?
(4)1s22s22p63s23p63d8?(2分)
(5)YCu3Ba2O7?(2分)
(6)2:1? (2分)
本题解析:略
本题难度:一般
2、填空题 甲、乙、?丙、丁为前三周期元素形成的粒子,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是______________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是______________________________。
(4)丁的元素符号是__________,它的原子结构示意图为__________。
(5)丁的氧化物的晶体结构与__________的晶体结构相似。
参考答案:(1)CaC2+2H2O====C2H2↑+Ca(OH)2
(2)答案略。(只要考生的答案符合题意要求,即可给分)
(3)N2+O2 2NO
2NO
(4)Si 
(5)金刚石
本题解析:根据题意第(1)问题中的信息可知CaC2与H2O反应,确定丙为C2-2,因此可以确定甲、乙、丙、丁均为14电子粒子,丁为原子,可确定为Si ,乙在高温下为工业上一种重要的还原剂,可确定为CO,甲为N2,SiO2为原子晶体,与金刚石的晶体结构相似。
本题难度:简单
3、选择题 碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是 ?
?
金刚石?石墨
A.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
B.相同质量的金刚石与石墨晶体中,所含共价键数相同
C.估计金刚石与石墨的熔沸点均较高,硬度均较大
D.根据:C(金刚石,s)+O2(g)===CO2(g)ΔH=-395.41 kJ?mol-1
C(石墨,s)+O2(g)===CO2(g)?ΔH=-393.5 kJ?mol-1
说明金刚石比石墨稳定,石墨转变为金刚石为放热反应
参考答案:A
本题解析:同素异形体之间的转化是化学变化,A正确;相同质量的金刚石与石墨晶体中,所含共价键数前者多,B不正确;石墨的硬度较小,C不正确;根据盖斯定律可知,金刚石转化为石墨的反应是放热反应,所以金刚石的能量高于石墨的,石墨比金刚石稳定,D不正确,答案选A。
点评:体系能量越低,是越稳定的,据此可以判断物质的稳定性。
本题难度:一般
4、填空题 天然气既是重要的能源,也是重要的化工原料,其主要成分是甲烷。
(1)甲烷在一定条件下可生成:
A.碳正离子(CH3-) ? B.碳负离子(CH3-)
C.甲基(—CH3)?D.碳烯(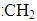 )
)
①四种微粒中,键角为120°的是________。(填序号)
②与碳负离子(CH3-)互为等电子体的一种分子的结构式为_________________________________________________________。
(2)海底富藏大量的可燃冰(甲烷的水合物),关于可燃冰的说法中正确的是________。
A.甲烷分子与水分子均是极性分子
B.可燃冰中甲烷分子与水分子间以氢键相结合
C.可燃冰属于原子晶体
D.甲烷分子与水分子中的σ键均是s—sp3电子云重叠而成的
(3)在高温下,甲烷可还原CuO得到Cu2O。
①Cu+的核外电子排布式为____________。
②Cu2O晶体的晶胞结构如图所示。其中“△”代表的离子符号为________。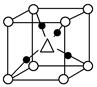
(4)一定条件下,甲烷与水蒸气可生成H2和CO。则所生成的气体中σ键总数与π键总数之比为________。
参考答案:(1)①A ② (2)D (3)①[Ar]3d10
(2)D (3)①[Ar]3d10
②O2- (4)2∶1
本题解析:(1)A中碳原子杂化为0+3=3,sp2,平面三角形。B中为1+3=4,sp3杂化,三角锥形。C中为1+3=4,sp3杂化,三角锥形。D中为1+2=3 ,sp2,平面三角形,由于孤电子对斥力大,所以键角小于120°。(2)A项,甲烷分子中正、负电荷中心重合,非极性分子,错误。B项甲烷中C—H无法形成氢键,错误。C项,可燃冰属于分子晶体,错误。(3)中由晶胞可知,黑球为4,白球为1,由于Cu2O,离子个数比为2∶1,可知,中心为氧离子。注意写Cu+,不是铜原子。
本题难度:一般
5、选择题 下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。示例:F2 根据各图表示的结构特点,下列有关叙述正确的是
根据各图表示的结构特点,下列有关叙述正确的是
[? ]
A.上述结构图中共出现6种元素
B.甲、乙、丙为非极性分子,丁为极性分子
C.甲与丁可以发生化合反应生成离子化合物
D.向CaCl2溶液中加入(或通入)丙有白色沉淀产生
参考答案:C
本题解析:
本题难度:一般