时间:2020-07-08 00:04:25
1、选择题 把表面有少量氧化物的铜片和铁片一起放入足量盐酸中充分反应,在该溶液中的金属离子是
[? ]
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温下,将铁片放入下列溶液中,能观察到有大量气泡产生的是
A.浓硫酸
B.稀硫酸
C.氢氧化钠溶液
D.硫酸铜溶液
参考答案:B
本题解析:A错,常温下,铁与浓硫酸发生钝化阻止反应的进一步进行。
B可以,铁与稀硫酸反应放出氢气。
C错,铁与氢氧化钠不发生反应。
D错,铁与硫酸铜发生置换,生成铜,不放出气体。
本题难度:简单
3、推断题 (7分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。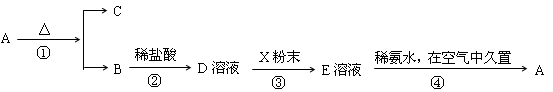
(1)请写出下列物质的化学式:A?、C?。
(2)在①②③④各步反应中属于氧化还原反应的有?(填序号)。
(3)请分别写出反应②的化学方程式和反应③的离子方程式:②?、③?。
参考答案:(1)A:Fe(OH)3? C:H2O
(2)③④
(3)Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
本题解析:由“E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色物质A”可推知A为氢氧化铁,则推知B为氧化铁,C为水,D为氯化铁,E为氯化亚铁。故
(1)A:Fe(OH)3? C:H2O
(2)①2Fe(OH)3 ?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
?Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
②Fe2O3 +6HCl=2FeCl3 +3H2O,无化合价的变化,属于非氧化还原反应。
③2FeCl3 +Fe=3FeCl2,Fe的化合价发生改变,属于氧化还原反应。
④4Fe(OH)2 +O2 +2H2O=4Fe(OH)3,Fe的化合价发生改变,属于氧化还原反应。
故答案是③④
(3)根据(2)的答案可知:Fe2O3 +6HCl===2FeCl3+3H2O? 2Fe3++Fe===3Fe2+
点评:熟悉物质的特殊性质作为推断题的突破口。结合题目的信息逐一确定。
本题难度:一般
4、选择题 下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题: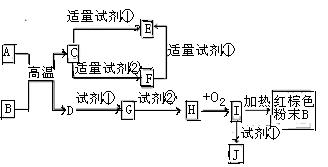
(1)写出物质C的化学式:?
(2)写出物质B的一种用途:?
(3)以J的饱和溶液制备胶体的操作为?
? ?。
?。
(4)写出下列反应的方程式:
A→F的离子方程式?.
H→I的化学方程式??
试剂②可以由一种淡黄色固体粉末和一种常见液体发生反应而制得,其相应的化学方程式?
(5)某同学认为J中可能同时含有同一种金属元素的两种阳离子,若要确认其中低价金属阳离子的存在,应选用?(选填序号)
A、KSCN溶液和氯水? B、铁粉和KSCN溶液? C、浓氨水? D、酸性高锰酸钾?
参考答案:(1) Al2O3 (2分)
(2)常用作红色油漆和涂料(写出其中一种即得分)(2分)?
(3)取一个烧杯,加入20mL蒸馏水,加热至沸,然后向沸水中滴加I的饱和溶液(或者氯化铁饱和溶液)1mL~2mL,继续煮沸,待溶液(或者液体)呈红褐色为止;(3分,关键词,每处1分)
(4) 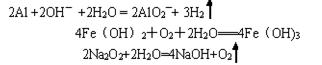
(5)D
本题解析:略
本题难度:一般
5、选择题 将FeO、Fe2O、Fe3O4混合物均分成两等份,在相同条件下,一份用足量H2还原,参加反应H2的体积为V1,另一份用足量浓NHO3处理得NO2(无其它还原性气体生成)气体体积为V2,若V1:V2=4:1(V1和V2均在相同条件下测定),测原混合物中各成分的物质的量之比可能为(?)
A.2:3:2
B.3:3:2
C.3:2:2
D.无法计算
参考答案:B
本题解析:V1:V2=4:1,设H2为4mol,生成NO2为1mol用氢气进行还原,铁的氧化物中铁全部变为0价,共得电子为8mol,与弄HNO3反应,生成NO2,铁全部变为+3价,共失电子为1mol,设FeO、Fe2O、Fe3O4分别为x、y、zmol,有2x+6y+8z=8,x+z=1,解得x=y,故选B。
本题难度:一般