时间:2020-07-08 00:04:05
1、选择题 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为 负极反应:C6Li-xe-==C6Li1-x+xLi+ (C6Li表示锂原子嵌入石墨形成的复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)。下列有关说法正确的是
[? ]
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-==C6Li
参考答案:BD
本题解析:
本题难度:一般
2、填空题 燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
参考答案:(11分)(1)①CH4+O2 CO2+2H2O (2分) ;
CO2+2H2O (2分) ;
②负极 (1分); 2O2+4H2O+8e-==8OH- (2分)
③减小 (1分) ; ④大于(1分)
(2)①2CH3OH+3O2+4OH-=2CO32-+6H2O (2分);
②负 (1分); 下降(1分)
本题解析:(1)①甲烷与氧气反应生成二氧化钛和水,故方程式为CH4+O2 CO2+2H2O。
CO2+2H2O。
②CH4失去电子,发生氧化反应,是负极,O2是正极,得到电子,发生还原反应,电极反应式为2O2+4H2O+8e-==8OH-。
③根据反应式可知,KOH发生反应,故电解质溶液的碱性减小。
④甲烷燃烧会浪费大量的能量,故甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率。
(2)①根据题中给出的反应物和生成物,该电池反应的总离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O。
②甲醇失去电子,化学价升高,发生氧化反应,故甲醇在负极发生反应。强碱参与了反应,故电池在放电过程中溶液的pH将降低。
考点:燃料电池 新型电源
点评:本题考查的是燃料电池和新型电源的相关知识,题目难度大,熟悉原电池的工作原理是解题的关键,注意基础知识的学习、掌握及应用。
本题难度:一般
3、选择题 高功率LaNi5H6 (氢的化合价为0价)电池已经用于混合动力汽车。总反应如下:LaNi5H6+6NiO(OH)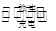 LaNi5+6Ni(OH)2
LaNi5+6Ni(OH)2
下列叙述正确的是
A.充电时储氢合金作阳极
B.放电时每转移6mol电子,有6moLNiO(OH)被氧化
C.充电时阳极周围pH增大
D.放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O
参考答案:D
本题解析:A、放电是原电池,充电是电解池,充电时原电池的负极接电源负极,原电池的正极接电源的正极,不能接反,储氢材料中H的化合价升高,原电池中作负极,充电时作阴极,错误;B、NiO(OH)+H2O+e-=Ni(OH)2+OH-,得电子化合价降低,被还原,放电时每转移6mole-,有6molNiO(OH)被还原,错误;C、阳极上发生的电极反应式:Ni(OH)2+OH--e-=NiO(OH)+H2O,消耗OH-,pH减小,错误;D、总电极反应式减去正极电极反应式得出:负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O,正确。
考点:考查原电池、电解池的相关知识。
本题难度:一般
4、选择题 下图装置为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
[? ]
A.闭合K时,K+从右到左通过离子交换膜
B.闭合K时,A的电极反应式为:3I--2e-=I3-
C.闭合K时,X的电极反应式为:2Cl--2e-=Cl2↑?
D.闭合K时,当有0.1mol K+通过离子交换膜,X电极上产生标准状况下气体1.12L
参考答案:D
本题解析:
本题难度:一般
5、选择题 芬兰籍华人科学家张霞昌研制的“超薄型软电池”获2009年中国科技创业大赛最高奖,被称之为“软电池”的纸质电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH)(碱式氧化锰).下列说法正确的是( )
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH-
参考答案:A、从电池反应可知,锌被氧化,失去电子,所以是负极,故A错误;
B、该电池反应中二氧化锰发生了还原反应,二氧化锰得到电子,被还原,为原电池的正极,故B错误;
C、该电池中电子由负极经外电路流向正极,则电流从正极二氧化锰流向锌,故C错误;
D、电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH-,或2MnO2+2e-+2H2O=2MnO(OH)十2OH-,故D正确.
故选D.
本题解析:
本题难度:简单