时间:2020-07-08 00:03:43
1、选择题 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
[? ]
A.阳极发生还原反应,其电极反应式:Ni2++2e-== Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
参考答案:D
本题解析:
本题难度:一般
2、填空题 Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ==="4LiCl" +S +SO2.请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是 ?
?.
(5)用此蓄电池电解含有0. 1 mol CuSO4和0. 1 mol NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 ?L,将电解后的溶液加水稀释至1 L,此时溶液的pH=?。
参考答案:(1)Li;4Li – 4 e- =" 4" Li+;
(2)2SOCl2+4 e- = 4Cl-+S+SO2↑;
(3)SOCl2+H2O = SO2↑+2HCl;
(4)SOCl2遇水易发生水解反应,其中S元素具有还原性,可被氧气氧化;
(5)0.224 ; 7
本题解析:结合电池总反应:4Li+2SOCl2 ="==4LiCl" +S +SO2 ,可知Li作负极,发生的电极反应为4Li – 4 e- =" 4" Li+;正极是碳,发生的电极反应是:2SOCl2+4 e- = 4Cl-+S+SO2↑。把少量水滴到SOCl2中,反应的化学方程式为SOCl2+H2O = SO2↑+2HCl。
由于SOCl2遇水易发生水解反应,且其中S元素具有还原性,可被氧气氧化,所以组装该电池必须在无水、无氧的条件下进行。
(5)用此蓄电池电解含有0. 1 mol CuSO4和0. 1 mol NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极发生的反应是:2Cl— -2e-=Cl2↑,负极发生的阴极反应是:Cu2++2e-=Cu,阳极产生的气体在标准状况下的体积是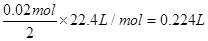 ,阴极有
,阴极有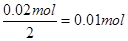 Cu析出,即Cu2+全部析出,则将电解后的溶液加水稀释至1 L,此时溶液为Na2SO4溶液,为中性溶液,pH为7。
Cu析出,即Cu2+全部析出,则将电解后的溶液加水稀释至1 L,此时溶液为Na2SO4溶液,为中性溶液,pH为7。
点评:主要考查电解池原理知识及其计算题,此题为历年高考的常考题型,具有一定的难度,重在考查学生对电化学原理的掌握情况,以及培养学生分析问题,解决问题的能力。
本题难度:一般
3、填空题 (16分)氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备氯化铁的装置如下图:(已知:废铁屑中的杂质不与盐酸反应)
(1)实验制备操作步骤如下:
Ⅰ.打开弹簧夹 (填“K1”或“K2”),关闭弹簧夹 (填“K1”或“K2”),并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过 操作后得到FeCl3·6H2O晶体。
Ⅳ.最后将FeCl3·6H2O晶体制成无水氯化铁。
(2)当盐酸与A中废铁屑接触后发生的化学反应方程式是: 。
(3)写出H2O2溶液中发生的反应的离子反应方程式: 。
(4)铁制品易生锈,采用电化学防腐的方式可以防止铁制品生锈,请利用石墨为辅助电极材料,完成铁制品防腐示意图,并做相应标注。
参考答案:(1)Ⅰ.K1(2分) K2(2分) Ⅱ.装置A中不产生气泡或量气管和水准管液面不变(2分) Ⅲ.蒸发浓缩、冷却结晶、过滤、洗涤(不写过滤洗涤液给分)(2分)
(2)Fe+2HCl==FeCl2+H2↑(2分)
(3)2Fe2++ H2O2+2H+="=" 2Fe3+ +2H2O(3分)
(4) (3分)
(3分)
本题解析: (1)实验室制备氯化铁时,先打开K1,关闭K2,并打开活塞a,缓慢滴加盐酸。这时在分液漏斗A中发生反应产生了FeCl2和氢气;Ⅱ.当装置A中不产生气泡或量气管和水准管液面不变时,时,关闭弹簧夹K1,打开弹簧夹K2,使A中溶液完全进入烧杯,这时FeCl2被氧化为FeCl3,然后关闭活塞a。Ⅲ.将烧杯中FeCl3溶液经过蒸发浓缩、冷却结晶、过滤、洗涤就得到了FeCl3·6H2O晶体,Ⅳ.最后将FeCl3·6H2O晶体制成无水氯化铁。(2)当盐酸与A中废铁屑接触后发生的化学反应方程式是:Fe+2HCl==FeCl2+H2↑;(3)在H2O2溶液中发生的氧化还原反应的离子反应方程式:2Fe2++ H2O2+2H+="=" 2Fe3+ +2H2O;(4)铁制品易生锈,采用电化学防腐的方式可以防止铁制品生锈,若利用石墨为辅助电极材料,则Fe电极是阴极,石墨电极是阳极,把它们连接插入水中,就可以用来保护Fe不被腐蚀。连接图示为: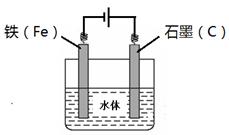
考点:考查物质的制取方法、混合物的分离、金属的电化学腐蚀与保护的知识。
本题难度:困难
4、选择题 用石墨电极电解CuCl2溶液,当有3.01×1023个电子转移时,在阴极上析出物质的质量为( )
A.16g
B.8g
C.32g
D.4g
参考答案:电解氯化铜溶液时,阳极上氯离子失电子发生氧化反应生成氯气,阴极上铜离子得电子发生还原反应生成铜单质,所以阴极上的电极反应式为Cu2++2e-=Cu,设当有3.01×1023个电子转移时,在阴极上析出物质的质量为x.
? Cu2++2e-=Cu
2×6.02×1023 64g
3.01×1023 x
所以x=16g,即析出铜的质量为16g,
故选A.
本题解析:
本题难度:简单
5、选择题 锌空气燃料电池具有安全、零污染、高能量、大功率、低成本及材料可再生等优点,因而被专家们认为是装备电动汽车等的理想动力电源。锌空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,锌为负极,空气电极为正极。下列说法正确的是(?)
A.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
B.以NaOH溶液为电解液时,负极反应为:Zn+4OH--2e-→ZnO2-+2 H2O
C.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+4e-→2O2-
D.电池工作时,电子通过外电路从正极流向负极
参考答案:B
本题解析:略
本题难度:简单