时间:2020-07-08 00:03:23
1、填空题 (1)共价键的____和____反映了共价键的强弱程度,________和________常被用来描述分子的空间构型。
(2)sp杂化轨道是由一个____和一个____组合而成的。每个sp杂化轨道含有1/2s和1/2p的成分。sp杂化轨道间的夹角为________,呈________型,如________。
(3)sp3杂化轨道是由一个____和________组合而成,每个sp3杂化轨道含1/4s和3/4p的成分,sp3杂化轨道间的夹角为_______,呈_______型,如________。
2、填空题 (三选一)【化学--选修物质结构与性质】
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是_______。C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是______________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为_______,每个COCl2分子内含有_____个δ键,______个π键。其中心原子采取_____杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是___________。
(3)CaTiO3晶体中(晶胞结构如图所示)? 晶体中,Z4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______; 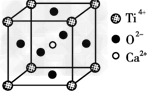
3、选择题 下列表达式错误的是
[? ]
A.甲烷的电子式: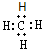 ?
?
B.氮原子的L层电子的电子排布图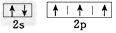 ?
?
C.硫离子的核外电子排布式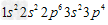 ?
?
D.碳-12原子 ?
?
4、填空题 (1)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种 配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为____________,第二种配合物的结构式为
___________,如果在第二种配合物溶液中滴加AgNO3溶液时,产生_____________现象。
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。 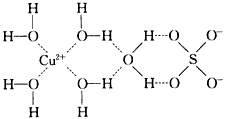
①写出基态Cu原子的核外电子排布式____________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________________
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应,如①CH2=CH2 ②CHCH  ④HCHO等,其中碳原子采取sp2杂化的分子有_____(填物质序号),预测HCHO分子的立体结构为______形。
④HCHO等,其中碳原子采取sp2杂化的分子有_____(填物质序号),预测HCHO分子的立体结构为______形。
5、选择题 电子由2p能级跃迁至3s能级时,可通过光谱仪直接摄取的是( )
A.电子的运动轨迹图象
B.原子的吸收光谱
C.电子体积大小的图象
D.原子的发射光谱