时间:2020-07-07 23:59:13
1、选择题 瓦斯爆炸是煤矿开采中的重大安全隐患,瓦斯分析仪能在矿井中的甲烷浓度达到一定浓度时,可通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池外电路中电子由电极b流向电极a
B.当固体电解质中有1molO2-通过时,电子转移2mol
C.电极a的反应式为:CH4+4O2-8e-=CO2+2H2O
D.电极b是正极,O2-由电极a移向电极b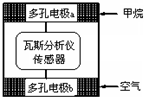
参考答案:A、该电池中a为负极,b为正极,电子从负极流向正极,所以电池外电路中电子由电极a流向电极b,故A错误;
B、1mol O2得4mol电子生成2molO2-,故当固体电解质中有1mol O2-通过时,电子转移2mol,故B正确;
C、选项中电荷不守恒,甲烷所在电极a为负极,电极反应为:CH4+4O2--8e-=CO2+2H2O,故C错误;
D、电极b氧气得电子,生成O2-,而电极a需要O2-作为反应物,故O2-由正极(电极b)流向负极(电极a),故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 人造地球卫星用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn + 2OH– –2e–=ZnO + H2O,Ag2O + H2O + 2e–=2Ag + 2OH–,下列叙述中,正确的是
A.Ag2O 是负极,并被氧化
B.电流由锌经外电路流向氧化银
C.工作时,负极区溶液pH减小,正极区pH增大
D.溶液中OH-向正极移动,K+、H+向负极移动
参考答案:C
本题解析:原电池负极锌失电子,发生氧化反应,电子经导线流向正极,Ag2O得电子,发生还原反应,而电流的方向和电子的流向正好相反。
由放电电极反应可知,负极消耗OH–,碱性减小,pH减小,而正极正好相反。
电解质溶液的阴离子一般向负极移动,阳离子一般向正极移动(或者说:负极由于消耗了OH—,故它向负极移动)
故答案为C
本题难度:一般
3、选择题 据报道,锌电池可能取代目前广泛应用的铅蓄电池,因为锌电池容量更大,而且没有铅污染.其电池反应为:2Zn+02=2ZnO,原料为锌粒、电解质和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应
D.电解液肯定是强酸
参考答案:A、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,故A错误;
B、Zn被氧化,应为原电池的负极,电极反应为Zn-2e-=Zn2+,故B正确;
C、原电池的正极发生得电子的还原反应,故C错误;
D、在强酸性环境下,不会生成氧化锌,故电解质一定不是强酸,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 甲烷燃料电池能量转化率高.以KOH为电解质溶液,分别向两极通入CH4和O2,即可产生电流,其电极反应分别为:CH4+10OH--8e-=CO32-+7H2O;2O2+8e-+4H2O=8OH-.下列说法错误的是( )
A.CH4在负极发生氧化反应
B.O2作为氧化剂发生还原反应
C.甲烷燃料电池实现了化学能转变为电能
D.分别将1molH2和CH4做燃料电池的原料,产生电量一样多
参考答案:A.失电子的物质在负极上发生氧化反应,根据方程式知,甲烷在负极上发生氧化反应,电极反应式为:CH4+2OH-+2O2=CO32-+3H2O,故A正确;
B.氧气在正极上得电子发生还原反应,电极反应式为:O2+2H2O+4e-═4OH-,故B正确;
C.燃料电池也是原电池,所以甲烷燃料电池实现了化学能转变为电能,故C正确;
D.将1molH2和CH4做燃料电池的原料,甲烷和氢气失去的电子不同,所以产生电量不同,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.该系统中只存在3种形式的能量转化
B.装置X能实现燃料电池的燃料和氧化剂再生
C.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化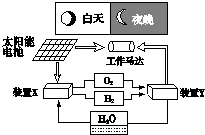
参考答案:A.存在能量转化形式有太阳能、机械能、化学能、电能,则不只是三种,故A错误;
B.在装置X中,电解水生成H2、O2,能实现燃料电池的燃料和氧化剂再生,故B正确;
C.装置Y为燃料电池,氢气在负极失电子被氧化,电极反应式是:H2-2e-+2OH-=2H2O,故C错误;
D.在装置X中,电解水生成H2、O2,实现了电能与化学能的转化;在装置Y中构成燃料电池,化学能转化为电能,作用于马达实现了电能与机械能的转化,故D错误.
故选B.
本题解析:
本题难度:一般