时间:2020-07-07 23:54:17
1、选择题 下列对元素周期表说法不正确的是
[? ]
A、在第ⅥB和第ⅦB族附近可以找到耐高温金属材料
B、第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性
C、如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置
D、目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质
2、选择题 医学研究证明,用放射性13553I治疗肿瘤可收到一定疗效,下列有关13553I叙述正确的是
[? ]
A.13553I是碘的一种同素异形体
C.13553I是一种新发现的元素
B.13553I位于元素周期表中第4周期ⅦA族
D.13553I核内的中子数与核外电子数之差为29
3、选择题 下列说法中正确的是
[? ]
4、选择题 A,B,C是周期表中相邻的3种元素,其中A,B同周期,B,C同主族。这3种元素在周期表中的位置可能 有以下4种排列方式,当此3种元素的质子数总和为31时,原子最外层电子数之和为17。则A,B,C 应是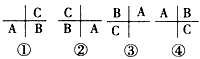
[? ]
A.A,B在周期表中第四周期,C在周期表中VA族
B.A,B在周期表中第三周期,A在周期表中ⅥA族
C.A,B在周期表中第二周期,C在周期表中ⅥA族
D.A,B在周期表中第一周期,C在周期表中0族
5、选择题 下列说法不正确的是
A.原子半径:Na
C.酸性强弱:H2SiO3