时间:2020-07-07 23:53:35
1、填空题 下表为周期表前20号元素中某些元素的有关数据:
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径 | 1.86 | 1.52 | 0.66 | 1.43 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
| 最高价态 | +1 | +1 | —— | +3 | +4 | +5 | +7 | +1 | +5 | —— |
| 最低价态 | —— | —— | -2 | —— | -4 | -3 | -1 | —— | -3 | -1 |
 m,该元素在周期表中的位置是?
m,该元素在周期表中的位置是?参考答案:(1)(2分)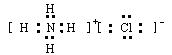
(2)CCl4?、 PCl3?(2分)(3)第三周期,第ⅥA族(2分)
(4)K (1分) (5)Al3+< F -< K+< Cl-(1分)
本题解析:略
本题难度:一般
2、选择题 X 、Y、 Z、 W是原子序数依次增大的四种短周期元素,A、B、C、D、F有其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(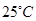 )。它们满足如图转化关系,则下列说法正确的是(?)
)。它们满足如图转化关系,则下列说法正确的是(?)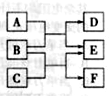
A.原子半径W>Z>Y>X
B.化合物F中含有共价键和离子键
C.在B和C的反应中,氧化剂是B,还原剂是C
D.Z元素的最高正价为+6
参考答案:B
本题解析:由题意可知D为一元强碱;根据B能与A、C反应生成同种物质且有一元强碱生成推断B是Na2O2,A是H2O,B是CO2,D是NaOH,E是O2,F是Na2CO3,则X、Y、 Z、 W分别是H、C、O、Na元素。A、根据元素周期律中原子半径的比较规律,原子半径W>Y>Z>X,错误;B、Na2CO3中含有共价键和离子键,正确;C、过氧化钠与二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,错误;D、O无最高正价,错误,答案选B。
本题难度:一般
3、填空题 (8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素;F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的价电子排布式?。
(2) B和C比较,第一电离能较大的是?(填元素符号),其原因为?。
(3)甲、乙两分子的中心原子的杂化类型是否相同?(相同、不相同)。
(4)已知化合物丁熔点190℃,沸点183℃。丙和丁比较,熔点较高的是?(填化学式),
(5)配合物戊由G3+与甲、元素F构成,已知该配合物的配位数为6。在含有0.1mol戊的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀。,则戊的化学式为?。
参考答案:(1)3d54s1 (2)N;N 原子价电子为2s22p3,2p轨道半充满,能量较低,难失1个电子,O原子价电子为2s22p4,易失1个电子;(3)相同;(4)NaCl;(5)[Cr(H2O)5Cl]Cl2
本题解析:根据题意可推出:A是H;B是N;C是O;D是Na;E是Al;F是Cl;G是Cr。甲是H2O;乙是H2O2;丙是NaCl;丁是AlCl3.(2)24号元素Cr基态原子的价电子排布式3d54s1;(2)一般情况下,同一周期的元素,元素的非金属性越强,其第一电离能越大,但是由于N原子核外的2p轨道上的电子处于半充满的稳定状态,能量较低,所以失去电子较难,因此N和O比较,第一电离能较大的是N;(3)在H2O和H2O2两分子的中心原子O的杂化类型是相同的,都是sp3杂化。(4)NaCl是离子晶体;而AlCl3.是分子晶体,分子晶体中分子之间通过分子间作用力结合,而离子晶体中离子之间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此熔点较高的是NaCl。(5)在0.1mol戊电离产生的Cl-的物质的量为:n(Cl-)="n(AgCl)=" 28.7g÷143. 5g/mol=0.2mol,因此在一个戊的外围含有2个Cl-.由于配合物戊由Cr3+与甲、元素F构成,已知该配合物的配位数为6。所以在其络离子中含有一个Cl-.其余的是水分子。因此根据化合物中正负化合价的代数和为0的原则,可知该络合物的化学式是[Cr(H2O)5Cl]Cl2。
本题难度:一般
4、选择题 已知a元素的阳离子,b元素的阴离子、c元素的阴离子具有相同的电子层结构,且b的阴
离子半径大于c的阴离子半径,则其原子序数大小顺序为(? )
A.c>b>a
B.a>b>c
C.a>c>b
D.c>a>b
参考答案:C
本题解析:根据“阴上阳下”的原则,a元素在下一周期,原子序数最大;b的阴离子半径大于c的阴离子半径,根据电子层数相同时,核电荷数越多,半径越小,判断b的原子序数小于c,所以原子序数大小顺序为a>c>b,答案选C。
本题难度:一般
5、选择题 下列对一些实验事实的理论解释正确的是?
| 选项 | 实?验?事?实 | 理?论?解?释 |
| A. | NH3溶于水形成的溶液微弱导电 | NH3是弱电解质 |
| B. | 氮气与氧气反应条件苛刻 | 氮元素的非金属性不强 |
| C. | 1体积水可以溶解600体积氯化氢气体 | 氯化氢分子很稳定 |
| D. | HF的沸点高于HCl | HF分子间存在氢键 参考答案:D 本题解析:氨气溶于水形成的溶液导电,一水合氨是电解质,氨气是非电解质,A不正确;氮气中含有三键,键能大,氮气稳定性强,但氮元素是活泼的非金属元素,B不正确;氯化氢的溶解性和氯化氢分子的稳定性没有关系,C不正确;HF的沸点高于HCl,这是由于HF分子间存在氢键,D正确,答案选D。 本题难度:一般 |