时间:2020-07-07 23:50:42
1、选择题 (1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是?。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是?,B可能是?。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是?L,质量是??g。
参考答案:(1)XY3 (2)N2(或CO或C2H4) H2 (3)11.2 14
本题解析:(1)根据阿伏加德罗定律可写出化学方程式:X2+3Y2=2Z,再根据质量守恒定律,可得Z的化学式应为XY3。
(2)由题意可得:n(A)+n(B)=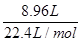 =0.4 mol,则3n(B)+n(B)=0.4 mol,即n(B)=0.1 mol,n(A)=0.3 mol。
=0.4 mol,则3n(B)+n(B)=0.4 mol,即n(B)=0.1 mol,n(A)=0.3 mol。
设B的相对分子质量为Mr,则A的相对分子质量为14Mr。
0.3×14Mr+0.1×Mr=8.6,解得Mr=2,则A、B的相对分子质量分别为28、2,A可能为N2、C2H4或CO,B可能是H2。
(3)由题意列方程组得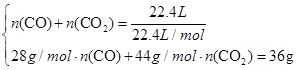
解得:n(CO)=0.5 mol,n(CO2)=0.5 mol
故V(CO)=11.2 L,m(CO)=14 g。
本题难度:一般
2、选择题 将4.48g Fe溶于1L 0.2mol·L-1的稀硫酸,再加入50mL 0.4mo1·L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-无剩余,生成一种氮氧化物NYOX。则该氮氧化物的化学式是
A.N2O
B.NO
C.N2O3
D.NO2
参考答案:A
本题解析:4.48g Fe的物质的量为0.08mol,则Fe2+全部转化成Fe3+,失去0.08mol电子,由电子守恒可知,0.050L× 0.4mo1?L-1=0.02mol NO3-得到0.08mol电子,氮元素化合价降4价,则生成的氮氧化物为N2O,答案选A。
考点:氧化还原反应的计算
本题难度:困难
3、选择题 人体血红蛋白中应含Fe2+,若食用亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒,下列叙述可能正确的是
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐被氧化
D.维生素C将Fe3+还原成Fe2+
参考答案:D
本题解析:由氧化还原的角度可知,亚硝酸盐是氧化剂,将Fe2+转化为高铁血红蛋白,被氧化。而维生素C是还原剂将Fe3+还原成Fe2+
点评:本题需要理解亚硝酸钠的中毒原理,从而推断出亚硝酸钠的强氧化性,所以可推断维生素C有还原性,本题需要有清晰的逻辑推理能力。
本题难度:一般
4、选择题 下列有关化学用语表示正确的是 (? )?
A.N2的电子式:
B.质子数为53,中子数为78的碘原子:
C.S2-的结构示意图:
D.CH4分子的比例模型:
参考答案:B
本题解析:氮气中每个氮原子还有2个没有参与成键的电子,电子式为 。硫离子的最外层有8个电子,应该为
。硫离子的最外层有8个电子,应该为 。
。 属于甲烷的球棍模型,比例模型为
属于甲烷的球棍模型,比例模型为 。所以答案是B。
。所以答案是B。
本题难度:一般
5、选择题 下列物质转化关系中,需要加入适当氧化剂的是
A.PCl3→PCl5
B.MnO4→Mn2+
C.SO3→SO42-
D.CO2→CO
参考答案:A
本题解析:需加入氧化剂,说明该物质被氧化,化合价升高。只有答案A。
本题难度:简单