时间:2020-07-07 23:49:18
1、填空题 (16分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: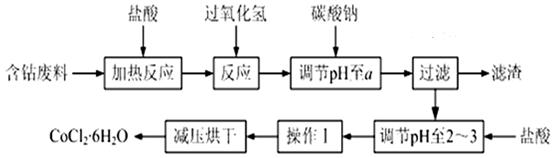
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
2、选择题 下列说法错误的是
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
3、选择题 用氯气跟单质化合不能制取的物质是
A.KCl
B.FeCl2
C.FeCl3
D.CuCl2
4、选择题 当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是(?)
A.NaOH
B.NaCl
C.NaHCO3
D.NH3·H2O
5、选择题 自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是( )
A.NaNO3
B.FeCl2
C.Na2SO4
D.AlCl3