时间:2020-07-07 23:47:54
1、选择题 在含有70克N2,128克O2和44克CO2的混和气体(标准状况)中,氮气所占体积百分比为
A.29.3%
B.33.3%
C.36%
D.50%
参考答案:B
本题解析:70克N2,128克O2和44克CO2的物质的量分别为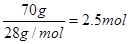 、
、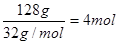 、
、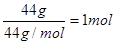 。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为
。因为在相同条件下,体积之比就是物质的量之比,所以氮气所占体积百分比为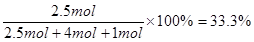 ,即选项B正确。
,即选项B正确。
本题难度:一般
2、选择题 下列化学反应中,H2SO4作为氧化剂的是
A.2NaOH+H2SO4=Na2SO4+2H2O
B.C+2H2SO4(浓)△CO2↑+2SO2+2H2O
C.BaCl2+H2SO4=BaSO4↓+2HCl
D.CuO+H2SO4=CuSO4+H2O
参考答案:B
本题解析:略
本题难度:简单
3、实验题 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实验。设计了如下图所示装置进行实验.已知:1.0 mol/L的Fe(NO3)3溶液的pH=1
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为?。
(2)实验前鼓入N2的目的是?。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO2具有____性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是?。
②按观点2,装置B中反应的离子方程式是?。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)?。
A.1 mol/L稀硝酸
B.1.5 mol/L Fe(NO3)2溶液
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液
参考答案:(1)分液漏斗
(2)排净装置中的空气,防止溶液中的SO2被空气中的氧气氧化,干扰实验。
(3)BaSO4?还原
(4)①静置一段时间后,溶液由棕黄色变成浅绿色
②3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+?③ C
本题解析:(2)反应前在通入N2,排除装置A中的空气,防止对实验干扰;
(3)硝酸具有强氧化性,白色沉淀是BaSO4,则说明二氧化硫具有还原性;
(4)分析各个观点,观点1是Fe3+把二氧化硫氧化,反应原理是,
2Fe3++SO2+Bs2++2H2O=2Fe2++BaSO4+4H+;Fe(NO3)3中含有Fe3+,A错;NO3?在酸性条件下有氧化性,B错;选C。
本题难度:一般
4、选择题 下列各项化学语言表达正确的是
A.F-的结构示意图:
B.HClO的结构式:H-O-Cl
C.HCl的电子式:
D.乙烯的结构简式:CH2CH2
参考答案:B
本题解析:略
本题难度:一般
5、选择题 自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等。试想,如果把某元素由化合态变为游离态,则该元素
A.被氧化
B.有可能被氧化,也有可能被还原
C.被还原
D.该元素既不被氧化也不被还原
参考答案:B
本题解析:元素由化合态变为游离态,可能是失去电子,比如:Cl2+2KBr=2KCl+Br2
也可能是得到电子,比如:Fe+CuCl2=FeCl2+Cu。所以有可能是被氧化,也有可能被还原。答案选B。
本题难度:简单