时间:2020-07-07 23:35:03
1、选择题 下列有关氨水的叙述中不正确的是( ? )
A.氨水中含有NH4+、OH-、H+三种离子
B.氨水就是液氨
C.氨水中含有NH3?H2O、NH3和H2O三种分子
D.氨水显碱性
2、选择题 关于氨的下列叙述中,错误的是
[? ]
A.氨易液化,因此可用来作制冷剂?
B.氨易溶解于水,因此可用来作喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
3、简答题 工业合成氨气的成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
(1)下图装置中能用于实验室制NH3的是______;用______法收集氨气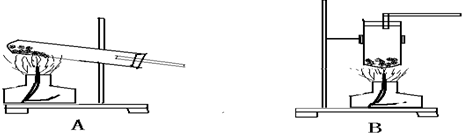
(2)写出用NH4Cl和Ca(OH)2制取氨气的反应方程式:______.
(3)检验集气瓶收集满氨气的方法______.
(4)NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:NH3
4、选择题 下列气体能用火碱干燥的是( )
A.CO2
B.NH3
C.SO2
D.HC1
5、选择题 下列反应说明氨气既有还原性,又有碱性的是
[? ]
A.4NH3+5O2=4NO+6H2O
B.3Cl2+8NH3=N2+6NH4Cl
C.3CuO+2NH3=3Cu+ N2+3H2O
D.NH3+HNO3=NH4NO3