时间:2020-07-07 23:33:41
1、选择题 X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;?0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol?L-1戊溶液中阴离子总的物质的量小于0.1mol
参考答案:C
本题解析:
本题难度:一般
2、选择题 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略),下列说法不正确的是( )
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可能反应生成Y
C.若X是金属镁,则W可能是强氧化性的单质
D.若X为甲醇,则X、Z的相对分子质量可能相差14
参考答案:C
本题解析:
本题难度:简单
3、推断题 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):a ____;b ___;c___ ;d ___;e ___。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a____;b___ ;c ___;d___ ;e ___。
参考答案:(1 )硫;硫化氢;二氧化硫;三氧化硫;硫酸
(2 )N2;NH3;NO ;NO2;HNO3
本题解析:
本题难度:一般
4、简答题 A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂.
(1)写出E的电子式:______.
(2)写出反应⑦的离子方程式:______.
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:______.
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:______.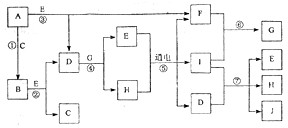
参考答案:B为淡黄色粉末,应为Na2O2,则A为Na,C为O2,E在常温下为液体,应为H2O,则D应为NaOH,F为H2,J可作禽流感、SARS等病毒的杀菌消毒剂,应为NaClO,为I和NaOH的反应产物,则气态单质I为Cl2,H为NaCl,G应为HCl,则
(1)E为H2O,为共价化合物,电子式为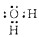
,故答案为: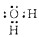
;
(2)反应⑦为Cl2和NaOH溶液的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)向AlCl3溶液中加入少量固体Na2O2,反应原理是过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑,
进而发生:AlCl3+3NaOH=Al(OH)3↓+3NaCl,反应的总方程式为可写为4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑,
故答案为:4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑;
(4)以Pt为电极电解滴加有少量酚酞的NaCl饱和溶液,阳极发生氧化反应,氯离子失去电子生成氯气,电极反应式为
2Cl--2e-=Cl2,故答案为:2Cl--2e-=Cl2.
本题解析:
本题难度:一般
5、简答题 Ⅰ.将70mL?NO和O2的混合气体通入足量的水中.(1)若正好完全反应生成HNO3,则原混合气体中O2和NO各多少毫升?(2)若在相同条件下收集到7mL剩余气体,则原混合气体中O2和NO各多少毫升?
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.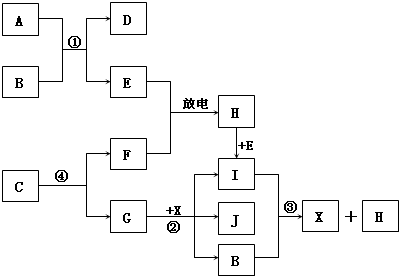
(1)D的焰色反应为黄色,则D的化学式为:______;F的化学式为______;
(2)写出反应①的离子反应方程式:______;
写出反应③的离子反应方程式:______.
(3)写出反应②的化学方程式:______.
(4)1mol?C通过反应④得到1mol?G,C中G的质量分数为72%,则C的化学式为:______.
参考答案:Ⅰ.(1)根据反应4NO+3O2+2H2O═4HNO3可知:
?当V(NO):V(O2)=4:3时,恰好完全反应,又V(NO)+V(O2)=70mL? 所以:V(NO)=40mL,V(O2)=30mL,
答:原混合气体中O2和NO分别为30ml、40ml;
(2)当剩余的气体为NO时,则消耗了V(NO)+V(O2)=70-7=63mL? 又因为消耗的V(NO):V(O2)=4:3,
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36+7=43mL,V(O2)=27mL,
当剩余的气体为O2时,则消耗了V(NO)+V(O2)=70-7=63mL? 又消耗的V(NO):V(O2)=4:3
则V(NO)=36mL,V(O2)=27mL,
∴原混合气体中V(NO)=36mL,V(O2)=(27+7)=34mL,
答:若在相同条件下收集到7mL剩余气体,若氧气过量,则原混合气体中O2和NO分别为27?ml、43ml;若若一氧化氮气过量,则原混合气体中O2和NO分别为34?ml、36ml;
Ⅱ.因I为红棕色气体,可知I为NO2,则H为NO,E为O2,F为N2;因反应③,可知这是NO2与水反应生成硝酸和NO,则B为H2O,X为HNO3;因A为淡黄色固体,能与水反应生成O2,可知A为Na2O2,D为NaOH;因J与盐酸反应生成不溶于X的白色沉淀,可知X为氯化银,G为Ag,反应④根据质量守恒,可知C中含有氮和银两种元素,再因1mol?C通过反应④得到1mol?G,说明1个C中含有1个Ag,C中G的质量分数为72%,则C的相对分子量为150,所以1个C中含有3个N,从而求出化学式为AgN3.
故答案为:(1)NaOH;?N2;
(2)2Na2O2+2H2O═4Na++4OH-+O2;3NO2+H2O═2H++2NO3-+NO;
(3)Ag+2HNO3═AgNO3+NO2↑+H2O;
(4)AgN3.
本题解析:
本题难度:一般